ISSN: 0210-1696
DOI: https://doi.org/10.14201/scero.32215
NEUROINFLAMACIÓN CRÓNICA Y DISFUNCIÓN INMUNITARIA EN EL SÍNDROME DE DOWN
Chronic Neuroinflammation and Immune Dysfunction in Down Syndrome
Jesús Flórez Beledo
Universidad de Cantabria. España
Recepción: 5 de septiembre de 2024
Aceptación: 3 de octubre de 2024
Resumen: El objetivo de este artículo es analizar las bases biológicas que concurren en dos especiales problemas patológicos que pueden perturbar la salud física y psicológica de las personas con síndrome de Down: la disfunción inmunitaria y el trastorno de regresión. La primera es causa de la mayor frecuencia y/o gravedad de infecciones, especialmente las respiratorias, y de la relativamente frecuente aparición de enfermedades autoinmunes. El segundo, de reciente identificación, muestra aspectos relacionados con la neuroinflamación crónica y la presencia de agentes estresores de diverso origen que inciden sobre un terreno particularmente vulnerable. Se analizan los factores etiológicos de estas dos condiciones patológicas, que pueden derivar de la triple representación génica del cromosoma 21.
Palabras clave: Síndrome de Down; disfunción inmunitaria; trastorno de regresión en el síndrome de Down; neuroinflamación crónica.
Abstract: This review is aimed at discussing the biological basis underlying two unique conditions that disturb the physical and mental health of the people with Down syndrome: the immune dysfunction and the Down syndrome regression disorder (DSRD). Immune dysfunction leads to more frequent and/or severe infectious diseases, especially in the respiratory system, and to a relatively higher presence of several autoimmune diseases. The recent identification of DSRD appears to be related to chronic neuroinflammation and autoimmune conditions that makes the brain more vulnerable to stressors. The unique relation to the genes disturbance secondary to the trisomy is also discussed.
Keywords: Down syndrome; immune dysfunction; Down syndrome regressive disorder; chronic neuroinflammation.
1. Introducción
Ha sido necesaria la devastadora pandemia COVID-19, con sus duras estadísticas sobre la morbilidad y la mortalidad de las personas con síndrome de Down (SD), para despertar al mundo relacionado con él sobre los problemas inmunológicos que caracterizan a tales personas. Y ha sido necesaria la aparición y la caracterización de un nuevo cuadro patológico, el ‘trastorno de regresión en el síndrome de Down’, para prestar atención a la neuroinflamación crónica presente en su cerebro desde etapas tempranas. Lo triste es comprobar que tanto la disfunción inmunitaria como la neuroinflamación en el SD eran realidades bien descritas en español, tanto en la literatura estrictamente científica como en algunas revistas y plataformas de divulgación y formación sobre el SD, pero no atravesaban la coraza del buenismo que ha caracterizado a importantes organizaciones.
El problema de la inmunodeficiencia fue amplia y rigurosamente explicado (Rahm y Chinen, 2011), enfatizando precisamente el peligro de las infecciones respiratorias. La presencia de la neuroinflamación cerebral y su posible papel en el estrés y en el trastorno regresivo fueron también largamente analizados (Flórez, 2014; Flórez y Ortega, 2020). Además de exponer con detalle sus características, ambas publicaciones insistían en la necesidad de mantenerse alerta y ofrecían recomendaciones de prevención.
El objetivo de este artículo es explicar de manera resumida la presencia de la neuroinflamación cerebral y de la disfunción inmunitaria como elementos propios del SD, derivados de la triple presencia del cromosoma 21.
2. La respuesta inflamatoria
La respuesta inflamatoria a la presencia de un elemento extraño y potencialmente lesivo en los tejidos de un individuo forma parte de los elementos que constituyen el papel del sistema general de su inmunidad. El proceso inflamatorio es la respuesta protectora del sistema inmunitario a un estímulo nocivo. A veces la inflamación puede ser exagerada y mantenerse sin beneficio aparente o incluso con graves consecuencias adversas (p. ej., reacciones alérgicas, de hipersensibilidad, enfermedades autoinmunes, inflamación crónica).
Elementos característicos son los cambios en la vascularización local; el aumento de la permeabilidad vascular con extravasación de plasma; la liberación de histamina y otros mediadores preexistentes; la llegada y la acumulación local de diversos tipos de leucocitos y subsiguiente síntesis y liberación de eicosanoides y la generación de radicales libres de oxígeno; y finalmente la producción y la liberación de citocinas, cuya acción persiste por periodos mucho más prolongados: sus consecuencias a menudo son evidentes incluso días después de iniciada la respuesta inflamatoria. Todo este complejo proceso tiene como finalidad restringir la lesión, suprimir el agente provocador y restituir la normalidad anatómica y funcional.
La inflamación puede ser aguda, como en la respuesta a una lesión del tejido, o puede ser crónica, lo que conduce paradójicamente a la destrucción progresiva del tejido.
La inflamación crónica se debe a la exposición continua de un elemento agresor. Esto puede ser el resultado de la persistencia de un agente patógeno como el cáncer o una enfermedad autoinmune en la que el autoantígeno activa de manera continuada a células con papel inmunitario o a la persistencia de estímulos que resultan específicamente insultantes para un determinado órgano.
Mientras los factores solubles, no proteínicos (p. ej., eicosanoides, bioaminas como la histamina) son preponderantes durante la inflamación aguda, los protagonistas de la inflamación crónica son las citocinas, quimiocinas, factores de crecimiento, enzimas y moléculas reactivas de oxígeno. Las citocinas son mediadores solubles que inician, terminan y modulan la intensidad de todos los aspectos de la respuesta inmunitaria o inflamatoria de un organismo. Aunque no existe una definición clásica de las citocinas, el término suele incluir a los interferones (IFN), las interleucinas (IL) y las quimiocinas. Por ejemplo, los linfocitos T citotóxicos y los linfocitos TH1 liberan IFN-γ capaz de activar macrófagos y células dendríticas indispensables en el proceso inmunitario. A su vez, estas células liberan diversos factores solubles como la IL-6 y el factor de necrosis tumoral (TNFα) que al final causan lesión tisular. El reemplazo del tejido perdido de esta manera, que es llevado a cabo por los fibroblastos, conduce a la fibrosis como resultado del exceso de factores de crecimiento, de citocinas y otros factores de origen vascular.
Las citocinas desempeñan, pues, una función esencial en la organización del proceso inflamatorio, en especial el TNFα y la IL-1. Otras citocinas y factores de crecimiento (IL-2, IL-6, IL-8, etc.) contribuyen a las expresiones de la respuesta inflamatoria.
3. La neuroinflamación crónica en el síndrome de Down
Las microglías, junto con los astrocitos, son células del sistema nervioso central que funcionan como elementos del sistema inmunológico, protegiendo al organismo de agresiones externas e internas. Al ser activada por un agente agresor, la microglía prolifera, adquiere una morfología distrófica ameboide, expresa una mayor cantidad de moléculas del MHC-II en su superficie (lo que la convierte en una célula presentadora de antígenos más apta) y libera diversas citocinas proinflamatorias y radicales oxidantes que alteran el terreno en que se encuentran.
El interés por la neuroinflamación en el cerebro del SD data de hace varios años. Una importante razón es la de valorar en qué grado su presencia puede condicionar o favorecer la evolución lenta, pero precoz y generalizada, hacia la enfermedad de Alzheimer. Pero el interés va más allá: hasta qué punto su presencia contribuye a la aparición de problemas cognitivos, emocionales, conductuales y neurológicos independientes de la enfermedad de Alzheimer propiamente dicha; qué factores la inician; si hay factores responsables de su cronificación.
Un dato importante es que ciertos signos de neuroinflamación cerebral aparecen ya en la etapa fetal. Flores-Aguilar et al. (2020) caracterizaron el perfil inflamatorio del cerebro a lo largo de la vida de personas con SD mediante el análisis de la morfología o rasgos de la microglía indicadores de inflamación y de la expresión de citocinas, tomando como muestra la corteza prefrontal desde la etapa fetal (16 semanas de gestación) hasta los 64 años de edad, en total: 127 casos; compararon los datos con muestras de las correspondientes edades en cerebros control. Apreciaron un aumento de la expresión de citocinas en los medios de cultivo obtenidos de muestras de corteza cerebral en fetos con SD ya en su segundo trimestre de gestación. En la corteza prefrontal de niños y jóvenes adultos con SD se observaron cambios morfológicos en la microglía (células en forma de bastones). Hubo aumento del nivel de IL-8 e IL-10 en niños con SD de 1-10 años; y hubo aumento de IL-1β, IL-1α, IL-8, IL-10, IL-15, eotaxina-3, proteína 10 inducida por IFNγ, quimiocina derivada de macrófagos y proteína-beta inflamatoria de macrófagos en adultos jóvenes con SD (13-25 años). En edades posteriores (39-68 años) se redujo la expresión de algunas citocinas mientras que se incrementaron los signos de distrofia microglial. En la Figura 1 se muestran los cambios evolutivos de los signos neuroinflamatorios a lo largo de la vida del grupo con SD.
Figura 1. Representación esquemática de la evolución de inflamación cerebral a lo largo de la vida de las personas con SD

Nota. Se aprecian cambios morfológicos tempranos, como son el aumento del tamaño del soma microglial, los aumentos de microglía tipo bastón y el aumento de diversas citocinas.
Este estudio muestra claramente la precocidad con que se inician los signos de neuroinflamación en el cerebro de fetos con SD y su incremento a lo largo de los primeros años, que se hace más evidente en la juventud y primera adultez, promoviendo así la permanencia de un estado de neuroinflamación crónica a lo largo de la vida. El estado inflamatorio no se reduce al existente en el cerebro, sino que se ha observado también a nivel sistémico, a juzgar por los datos obtenidos en diversos órganos y líquidos corporales (Huggard et al., 2020; Sullivan et al., 2017). ¿Qué factor o factores pueden ser los responsables de una iniciación tan temprana de la neuroinflamación y de su posterior incremento? La sobreexpresión de diversos genes y su correspondiente desequilibrio funcional pueden actuar como agente desencadenante y promotor; tal puede ser la contribución del gen SOD-1 con el correspondiente incremento de radicales libres de oxígeno y disfunción mitocondrial en neuronas y células de carácter inflamatorio (Busciglio y Yankner, 1995). Conocida es la actividad proinflamatoria de la proteína β-amiloide y su incrementada presencia ya en el cerebro de los fetos con SD (Welikovitz et al., 2020). Asimismo, los genes que codifican los receptores de los interferones: la mayor presencia de estos receptores provocará hiperactividad por aumento de la señalización y desequilibrará su actividad proinflamatoria (Galbraith et al., 2023).
4. El papel de los agentes estresores
Una vez abonado y preparado el terreno cerebral en la etapa fetal y primeros meses postnatales, los estímulos externos e internos que denominamos agentes estresores, que ponen en marcha importantes y complejos circuitos neuroendocrinos, van activando e incrementando la respuesta inflamatoria que se expresará en el aumento de citocinas (IL-1, IL-6, IL-10 y otras varias) y en cambios morfológicos y funcionales de la microglía y astrocitos: la neuroinflamación queda asegurada. Su intensidad y consecuencias sobre la función de los diversos núcleos y circuitos cerebrales dependerán de las características biológicas de cada individuo. Los estresores, pues, en función de su intensidad y duración, son capaces de iniciar y mantener este proceso neuroinflamatorio e inmune (Glaser y Kielcot-Glaser, 2005).
Los diversos factores estresores actúan sobre el cerebro, en donde inician una respuesta hormonal que comienza en el hipotálamo cerebral donde se segrega la hormona liberadora de corticotropina (CRH o CRF); esta actúa sobre la hipófisis anterior para segregar la hormona adrenocorticotropa (ACTH), la cual finalmente estimula la producción de las hormonas de la corteza suprarrenal, especialmente el cortisol. Adicionalmente, los estresores promueven la secreción de prolactina y hormona del crecimiento, y, a través del sistema nervioso vegetativo, la activación de la médula suprarrenal de donde son segregadas la adrenalina y la noradrenalina (Figura 2).
Figura 2. Modulación de la respuesta hormonal al estrés por parte del sistema nervioso central
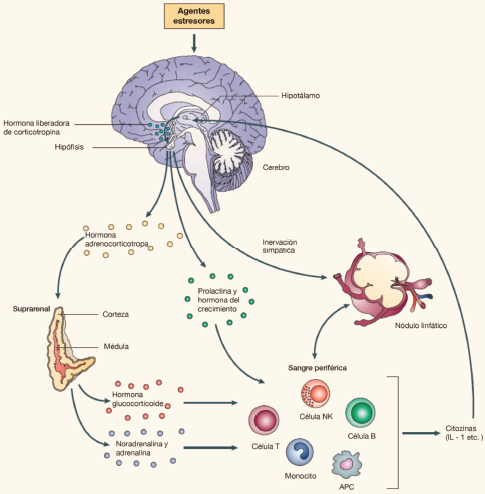
¿En qué grado el exceso de acción estresante (sea por intensidad o por duración) ocasiona una respuesta exagerada en la secreción de todas estas hormonas? ¿En qué grado la hiperactividad de estas hormonas influye en la disregulación de los componentes de la respuesta inmunitaria? ¿En qué grado todo ello termina por abonar el terreno cerebral sobre el que surja la depresión? ¿En qué grado todo ello se puede ver facilitado, además, por las condiciones fisiológicas y psicológicas propias del síndrome de Down?
De entrada, hay que afirmar que la respuesta al estrés, promovida desde el eje HPA, es una respuesta fisiológica y útil que dota al organismo de un mecanismo de defensa: activa determinadas vías metabólicas, inmunológicas y conductuales que permiten al individuo afrontar los problemas físicos y psicológicos que le acechan. El problema surge cuando esta respuesta al estrés es excesiva en intensidad o en duración, y lo que son acciones fisiológicas de las diversas hormonas implicadas se convierten en acciones suprafisiológicas, peligrosas. Incluso puede ocurrir que algunos de los elementos activados sean capaces de reestimular y reiniciar el mecanismo de respuesta, en un proceso de autoestimulación mantenida.
La acción de la CRH, activada por el agente estresor, no se limita a estimular la secreción de ACTH. Para empezar, la CRH es sintetizada mayoritariamente en las neuronas del núcleo paraventricular del hipotálamo que proyecta a la eminencia media, pero también es producida por numerosas neuronas de otros núcleos hipotalámicos, corteza cerebral, núcleo ventral de la amígdala, núcleo del lecho de la estría terminal, sustancia innominada, diversas regiones del hipocampo, septum y muy diversos núcleos del tronco cerebral incluidos el locus coeruleus, la sustancia gris periventricular, el núcleo parabraquial y el núcleo del tracto solitario. La extensa distribución de la CRH y su lógica asociación con la secreción de ACTH a la que estimula explican el importante papel que el sistema CRF cerebral desempeña en los estados de adaptación al estrés, el aprendizaje y la memoria (Flórez y Pazos, 2025). En efecto, los estímulos estresantes provocan la estimulación del sistema CRF y la liberación de este neuropéptido a nivel hipotalámico con el consiguiente aumento de ACTH y de hormonas corticoides. Pero, al mismo tiempo, activan otros grupos neuronales CRF, cuya función ya no es incrementar la secreción de ACTH, sino activar determinados núcleos cerebrales que contribuyen a formar la respuesta al estímulo estresor: aumento de la actividad proinflamatoria de la neuroglia y la liberación intracerebral de citocinas, aumento de actividad simpática e incremento del estado de vigilia (mediante la activación del locus coeruleus y su sistema difuso de activación), inhibición de la ingesta alimenticia y de la actividad psicomotora, interrupción de conductas interactivas o aumento de la conducta de evitación que indican cierto estado de ansiedad o de conflicto. El exceso de la acción CRH y del cortisol en el cerebro, tal como vemos en el estrés prolongado, entorpece o reduce la neurogénesis y facilita la neuroinflamación y la apoptosis neuronal, lo que puede explicar la reducción del volumen del hipocampo asociada a la depresión.
Pero, además de su acción cerebral, la CRH actúa periféricamente sobre sus receptores situados en células implicadas en la respuesta inmunitaria: linfocitos T, monocitos y macrófagos, en los que favorece la producción de la IL-1. La consiguiente producción de quimiocinas y citocinas va a influir sobre el propio cerebro.
5. Agentes estresores en el síndrome de Down
No debemos minimizar el estrés en la vida de una persona solo porque esta no verbalice sus preocupaciones. Es importante saber que la persona con síndrome de Down puede estar experimentando estrés y puede estar necesitando ayuda para desarrollar estrategias saludables con las que afrontarlo. McGuire y Chicoine (2021) han analizado extensamente la presencia de factores estresantes más frecuentemente encontrados en las personas con síndrome de Down. Consideran particularmente importantes los siguientes:
•impotencia o debilidad aprendida,
•falta de oportunidades,
•falta de respeto,
•acontecimientos esperados, pero estresantes,
•acontecimientos inesperados y estresantes,
•pena, sufrimiento, duelo.
En muchas ocasiones han de enfrentarse con determinados problemas con los que no tiene que enfrentarse el resto de las personas. Y a cualquier edad.
Sin ánimo de agotar las situaciones reales que les pueden resultar estresantes, ya desde pequeños son “obligados” a realizar ejercicios y programas que, en principio, no desean realizar porque están por encima de su hipotonía y tendencia a la pasividad. A hacer cosas para las que no tienen ganas y que no entienden por qué han de hacerlas. A compartir su vida con otros niños a los que no entienden o que arman un barullo que los aturde. A participar durante todo el día en una actividad tras otra, con horarios extremos, empujados por la ansiedad bienintencionada de sus padres, que les desborda, y vuelven rendidos a casa. A ir a un colegio cuya actividad les obliga a esforzarse y superarse constantemente, y en donde frecuentemente se sienten postergados porque no les hacen caso y con sensación de fracaso. A vivir y formar parte de realidades que no terminan de entender. A vivir en residencias donde puede haber ciertas personas que tengan hábitos inconvenientes, que permanezcan despiertas por la noche o simplemente que no les gusten. Y, a pesar de ello, quizá tengan pocas oportunidades para negociar un cambio o para vivir con quienes desearían.
Además, la discapacidad intelectual y los problemas de lenguaje derivados del síndrome de Down suelen limitar la habilidad de la persona para afrontar el estrés. Por consiguiente, hay momentos en que estos adultos pueden experimentar tanto estrés, si no más, como cualquiera de nosotros, con la diferencia de que ellos tienen menos habilidad para expresarlo, darlo a conocer y pedir ayuda, y sobrellevarlo.
En la población general, la presencia del estrés en la vida de una persona no suele provocar una enfermedad mental, porque el apoyo adecuado, el saber apartarse de la situación, el participar en actividades que reducen el estrés y el hacer uso de adecuadas estrategias son medios que ayudan a evitar el desarrollo de una enfermedad mental. Sin embargo, se hace preciso reconocer el estrés, sus síntomas, con la finalidad de desarrollar activamente esas estrategias que nos permitan afrontarlo y sobreponernos. Con toda seguridad, el individuo con síndrome de Down desde pequeño no reconoce su propio estrés ni es capaz de verbalizar sus problemas que quizá los resuelva con determinadas formas de conducta. No debemos minimizar el estrés en la vida de una persona solo porque esta no verbalice sus preocupaciones. Es importante saber que la persona con síndrome de Down puede estar experimentando estrés, y puede estar necesitando ayuda para desarrollar estrategias saludables con las que afrontarlo.
6. El trastorno de regresión en el síndrome de Down
Por último, y ciñéndonos expresamente al trastorno de regresión en el síndrome de Down, su complejidad solo se explica por el alto grado del factor “individualidad” que caracteriza al propio síndrome. Una individualidad que comprende factores intrínsecos y extrínsecos. Entre los primeros destacan: a) el grado de desarrollo de la neuroinflamación a lo largo de las primeras etapas de la vida, porque es la que va a condicionar el nivel de vulnerabilidad del terreno cerebral; b) el grado de desarrollo de la disfunción inmunitaria, porque es la que va a condicionar, por una parte, la calidad y la intensidad de la respuesta inmune y, por otra, la incorporación de posibles elementos de tipo autoinmunitario (Jafarpour et al., 2024). Los factores extrínsecos pertenecen a la historia vital de cada individuo, como son: los antecedentes infecciosos, la posible aparición de un estímulo lesivo (infeccioso o tóxico) que sea el desencadenante de una cascada reactiva asociada a una respuesta inmunitaria desequilibrada, los acontecimientos vitales, el grado de resistencia o de sensibilidad a los agentes estresores que surgen a lo largo de la vida, entre otros (Cuadernos de Actualidad, 2023). Tengamos en cuenta que su aparición suele coincidir con una edad ―adolescencia, joven adultez― en la que predominan intensas transiciones y situaciones decisivas en la vida de una persona con síndrome de Down, cuya madurez progresa de forma más lenta y más limitada.
7. El sistema inmunitario
El sistema inmunitario es el encargado de defender al organismo frente a todo peligro procedente del microentorno. Se compone de muy diversos tipos celulares organizados en distintas estructuras con una ordenación funcional exquisita. Su correcto funcionamiento se sustenta en tres pilares: a) identificar las situaciones de peligro, para saber cuándo debe activarse; b) seleccionar las células más adecuadas para responder a cada agente agresor, y c) minimizar el daño al propio organismo, regulando la intensidad de la respuesta y evitando agredir al organismo propio (García-Sanz y López-Hoyos, 2025).
Para comprender la respuesta inmunitaria es preciso distinguir sus dos tipos: la natural o innata y la adquirida o adaptativa. Las células de la respuesta innata siempre se han considerado “inespecíficas”, al no contar con un único receptor frente a estímulos y al no expandirse clonalmente. En ella se incluyen todos los leucocitos sanguíneos, a excepción de los linfocitos. Los elementos típicos de la respuesta adquirida son los linfocitos T y los linfocitos B y las moléculas solubles producidas por estos últimos, las inmunoglobulinas (Ig). Las células de la respuesta adquirida, los linfocitos T y B, tienen un receptor que reconoce un antígeno exclusivo de forma muy específica, y ese encuentro provoca una expansión clonal de la célula específica de ese antígeno, generando memoria inmunológica. Se distinguen dos tipos de linfocitos T: las células T-CD8+, que son células eminentemente efectoras que participan en los fenómenos de citotoxicidad, y los linfocitos T-CD4+, que son los principales productores de las citocinas y controlan la activación del resto de componentes de la RI, junto con las células dendríticas.
Las células dendríticas (DC) derivan del mismo precursor mieloide de la médula ósea que los granulocitos y los macrófagos, aunque su capacidad fagocítica es mucho menor. No obstante, es una célula clave en la respuesta inmunitaria porque establece la interacción necesaria con el linfocito T-CD4+ para coordinar los dos tipos de respuesta inmunitaria.
Las respuestas innata y adquirida son dos planteamientos estratégicos diferentes del sistema inmunitario para enfrentarse a un agente agresor; ambos son dependientes el uno del otro y están muy coordinados entre sí. El sistema inmunitario innato reconoce señales de peligro y pone en marcha dos sistemas efectores básicos que le permiten eliminar potenciales agentes agresores: la fagocitosis y la citotoxicidad; el sistema inmunitario adaptativo es complementario: reconoce «lo imprevisto» y mejora el rendimiento de la respuesta innata.
8. La disfunción inmunitaria en el síndrome de Down
Las personas con SD muestran una sustancial disfunción del sistema inmunitario, una disfunción que se expresa fundamentalmente por dos características aparentemente contradictorias: a) un mayor riesgo de padecer infecciones y que estas sean más graves, y b) una mayor frecuencia de sufrir diversas enfermedades autoinmunes, como son algunas alteraciones tiroideas (enfermedad de Graves), diabetes tipo 1, enfermedad celíaca, patología reumática, patología dérmica (alopecia areata, hidradenitis supurativa), patología neurológica (enfermedad de Moyamoya, trastorno de regresión) (Hom et al., 2024). Aparentemente, coinciden signos que podrían denotar menor capacidad inmunitaria frente a otros que parecen indicar un exceso de actividad inmunitaria. El término “disfunción” refleja esa ambivalencia en la regulación de la inmunidad.
Se acepta universalmente que el desequilibrio en las acciones de ciertos genes propios del cromosoma 21, ocasionado por su triple presencia en el síndrome de Down, impacta negativamente sobre las vías que regulan la respuesta inmunitaria, perturba la apoptosis, y eso lleva a una hiperactivación de las células T y B ante antígenos propios, que imita a la que es propia de la respuesta ante antígenos extraños: es la base de la autoinmunidad. En este sentido, en el cromosoma 21 se encuentran genes determinantes en la respuesta inmunitaria como son el llamado gen regulador autoinmune (AIRE) y cuatro de las seis subunidades de receptores del interferón (IFN), que actúan como receptores de los interferones y de las interleucinas IL-10, IL-22 e IL-26 (Jafarpour et al., 2024).
Además, en el cromosoma 21 se encuentran micro-ARNs que no codifican proteínas, pero inhiben la expresión de otros genes que sí son capaces de sintetizar proteínas que intervienen en la regulación de la inmunidad y de la actividad antiinflamatoria (Hom et al., 2024).
Se van caracterizando en el SD las anomalías observadas en la población de las células propias del sistema inmunitario, tanto el innato como el adaptativo, así como en sus respectivas funciones (Bordon, 2023; Ramba y Bogunovic, 2024). Es importante reconocer que tales anomalías varían a lo largo de la vida y que, en general, son más abundantes y marcadas en la niñez y la adolescencia; no en vano son las etapas más sensibles a las infecciones y en las que se suelen iniciar e identificar las enfermedades autoinmunitarias.
Dentro del sistema inmunitario innato, en el campo de los granulocitos se aprecia neutrofilia en el recién nacido, menor número de granulocitos en la edad 0-12 años y de eosinófilos en la niñez y adultez joven, alteración en la quimiotaxis celular de los neutrófilos y en sus capacidades bactericidas. Los monocitos muestran alteraciones en la fagocitosis y quimiotaxis y, sobre todo, un aumento de los receptores de los interferones (IFN) IFNAR1, IFNRA2, IL10RB, con el correspondiente aumento de sus sistemas asociados de señalización JAK/STAT y de los niveles de los genes que son estimulados por los IFN. La acción citotóxica propia de las células citotóxicas naturales de origen linfoide (NK) está aumentada.
Dentro del sistema inmunitario adaptativo, hay que distinguir entre los linfocitos T y los B. Respecto a las células T, hay deficiencia en la niñez temprana que se va normalizando conforme avanza la edad, con producción y salida lentas en el timo. Las células CD8+ producen una marcada liberación de citocinas y puede estar disminuida la función de las células T reguladoras. Aunque hay una importante reducción de células B, productoras de anticuerpos específicos, se observan niveles altos de autoanticuerpos; de hecho, expresan marcadores propios de enfermedades autoinmunes. Puede haber aumento de IgG con reducción de IgM e IgE. Las respuestas a la vacunación son variadas: en algunos casos se aprecia una aceleración en el declive de anticuerpos tras la vacunación o incluso una falta de respuesta a la vacunación.
El profundo desequilibrio originado por la presencia de un tercer cromosoma 21 sobre la respuesta inmunitaria explica la compleja disregulación de esta respuesta en el SD. Y lo hace tanto por la triple cantidad de genes pertenecientes en ese cromosoma y directamente relacionados con la respuesta como por la influencia que genes del 21 ejercen sobre la actividad de otros genes igualmente relacionados con la inmunidad y presentes en otros cromosomas.
En la Figura 3 se resumen los principales elementos del sistema inmune en el SD que contribuyen a la autoinmunidad y a la gravedad de ciertas infecciones, especialmente las respiratorias (Ramba y Bogunovic, 2024). El aumento de las células CD11c+B, la disregulación de las células T, el aumento de liberación de citocinas y la generación de anticuerpos autorreactivos contribuyen al aumento de la autoinmunidad. La triplicación de los 4 receptores de interferones (IFNAR1, IFNAR2, IFNGR2 e IL10RB) y sus correspondientes vías de señalización parecen contribuir a la gravedad de las infecciones; igualmente lo hacen la disminución de ciertas células B, el aumento de una regulación de carácter negativo por parte del gen USP18 (inducido por IFN1) y la menor respuesta a la vacunación.
Figura 3. Elementos del sistema inmune en el síndrome de Down que contribuyen al mayor desarrollo de la autoinmunidad y a la mayor gravedad de las infecciones
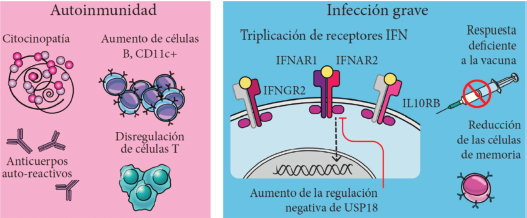
9. Conclusión
Si tuviéramos que elegir un término para cualificar el origen de todas estas alteraciones sería el de “desequilibrio” en un proceso tan complejo y delicado como es el que tiene lugar en las respuestas inflamatoria e inmunitaria. Un desequilibrio que tiene su origen en la propia irregularidad con que determinados genes del cromosoma 21, implicados en la respuesta inflamatoria e inmunitaria, actúan y se relacionan con otros genes, como consecuencia de la triple presencia del cromosoma. Este desequilibrio, por una parte, trastorna la defensa ante un agente externo (microorganismo, trauma, estímulo estresor, tejido ajeno), sea reduciendo la capacidad fagocítica y/o la calidad y cantidad de anticuerpos, o exagerando inútilmente la producción interna de agentes (p. ej., citocinas y quimiocinas), que terminan siendo autolesivos. Y, por otra, trastorna el reconocimiento de su propio tejido y le hace equivocarse y poner en marcha una respuesta autoinmunitaria contra él.
En relación con el trastorno de regresión, la cronificación y la persistencia sin límites en el cerebro de un estado inflamatorio, al que se suma una indebida respuesta inmune, lo debilitan y lo hacen más frágil ante potenciales agentes específicos lesivos, como pueden ser los radicales activos de oxígeno o las múltiples consecuencias originadas por estímulos estresores.
10. Referencias bibliográficas
Bordon, Y. (2023). Immune dysregulation in Down syndrome. Nature Reviews, Immunology, 23, 201-204.
Busciglio, J. y Yankner, B. A. (1995). Apoptosis and increased generation of reactive oxygen species in Down’s syndrome neurons in vitro. Nature, 378, 776-779.
Cuadernos de Actualidad. (2023). El trastorno de regresión en el síndrome de Down. Síndrome de Down: Cuadernos de Actualidad, 6. https://www.down21.org/libros-online/Boletines-Down21/El-trastorno-de-regresion-en-el-sindrome-de-down-6.pdf
Flores-aguilar, L., Florencia Iulita, M., Kovecses, O., Torres, M. D., Levi, S. M., Zhang, Y., Askenazi, M., Wisniewski, T., Busciglio, J. y Coello, C. (2020). Evolution of neuroinflammation across the lifespan of individuals with Down síndrome. BRAIN a Journal of Neurology, 43, 3653-3671.
Flórez, J. (2014). Depresión y regresión en el síndrome de Down: Apuntes para una teoría patogenética. Síndrome de Down: Vida Adulta, 17. https://www.sindromedownvidaadulta.org/revista-de-adultos-n-17-junio-2014/articulos-no17/depresion-y-regresion-en-el-sindrome-de-down-apuntes-para-una-teoria-patogenetica/
Flórez, J. y Ortega, M. C. (2020). Regresión de origen desconocido en el síndrome de Down. Fundación Iberoamericana Down21.
Flórez, J. y Pazos, A. (2025). Neurotransmisión en el sistema nervioso central. En J. Flórez, A. Mediavilla y C. Avendaño (Dirs.), Farmacología Humana. 7.ª ed. (pp. 407-428). Elsevier.
Galbraith, M. D., Rachubinski A. L., Smith K. P., Araya P., Waugh, K. A., Enriquez-Estrada, B., Worek K., Granrath, R. E., Kinning, K. T., Eduthan, N. P., Ludwig M. P., Hsieh, E. W. Y., Sullivan, K. D. y Espinosa, J. M. (2023). Multidimensional definition of the interferonopathy of Down syndrome and its response to JAK inhibition. Science Advances, 9(26), eadg6218. https://doi.org/10.1126/sciadv.adg6218
García-Sanz, M. M. y López- Hoyos, M. (2025). Farmacología de la respuesta inmunitaria. En J. Flórez, A. Mediavilla y C. Avendaño (Dirs.), Farmacología Humana. 7.ª ed. (pp. 375-404). Elsevier.
Glaser, R. y Kielcot-Glaser, J. K. (2005). Stress-induced immune dysfunction: Implications for health. Nature Reviews, Immunology, 5, 243-251.
Hom, B., Boyd, N. K., Vogel, B. N., Nishimori, N., Khoshnood, M. K., Jafarpour, S. Nagesh, D. y Santoro, J. D. (2024). Down Syndrome and Autoimmune Disease. Clinical Reviews in Allergy and Immunology. https://doi.org/10.1007/s12016-024-08996-2
Huggard, D., Kelly, L., Ryan, E., McGrane, F., Lagan, N., Roche, E., Balfe, J., Leahy, T. R., Franklin, O., Doherty, D. G. y Molloy, E. J. (2020). Increased systemic inflammation in children with Down syndrome. Cytokine, 127, 154938.
Jafarpour, S., Banerjee, A. K., Khoshnood, M. M., Vogel, B. N., Boyd, N. K., Nguyen, L., Partridge, R., Santoro, S. L., Gombolay, G. Y., Fisher, K. S., Real de Asua, D., Ortega, M. C., Franklin, C., Rafii, M. S. y Santoro, J. D. (2024). De novo variants in immune regulatory genes in Down syndrome regression disorder. Journal of Neurology, 271(8), 5567-5576.
McGuire, D. y Chicoine, B. (2021). Mental wellness in adults with Down syndrome. A guide to emotional and behavioral strengths and challenges. 2.ª ed. Woodbine House. [Traducción al español (2023). https://www.down21.org/libros-online/bienestar-mental-en-los-adultos-con-sindrome-de-down-2-edicion.jpg.pdf]
Rahm, G. y Chinen, J. (2011). Infecciones e inmunodeficiencia en el síndrome de Down. Revista Síndrome de Down, 28(3), 70-81. https://revistadown.downcantabria.com/wp-content/uploads/2011/06/revista109_70-81.pdf
Ramba, M. y Bogunovic, D. (2024). The immune system in Down Syndrome: Autoimmunity and severe infections. Immunological Reviews, 322, 300-310. https://doi.org/10.1111/imr.13296
Sullivan, K. D., Evans, D., Pandey, A., Hraha, T. H., Smith, K. P., Markham, N., Rachubinski, A. L., Wolter-Warmerdam, K., Hickey, F., Espinosa, J. M. y Blumenthal, T. (2017). Trisomy 21 causes changes in the circulating proteome indicative of chronic autoinflammation. Science Report, 7, 14818.
Welikovitch, L. A., Do Carmo, S., Magloczky, Z., Malcolm, J. C., Loke, J., Klein, W. L., Freund, T. y Claudio Cuello, A. (2020). Early intraneuronal amyloid triggers neuron-derived inflammatory signaling in APP transgenic rats and human brain. Proceedings National Academy of Sciences USA, 117, 6844-6854.