eISSN 2444-7986
DOI: https://doi.org/10.14201/orl.27450
ARTÍCULO DE REVISIÓN
CIRUGÍA RADIOGUIADA DE PARATIROIDES CON 18FCH. MITO O REALIDAD
Radioguided parathyroid surgery with 18FCH. Myth or reality
Juan I. RAYO-MADRID  ; José R. INFANTE de la TORRE
; José R. INFANTE de la TORRE  ; Andrés MARTÍNEZ-ESTEVE
; Andrés MARTÍNEZ-ESTEVE  ; Pedro JIMÉNEZ-GRANERO
; Pedro JIMÉNEZ-GRANERO  ; Álvaro BAENA-GARCÍA
; Álvaro BAENA-GARCÍA  ; M. Carmen LAVADO-PEREZ
; M. Carmen LAVADO-PEREZ  ; Justo SERRANO-VICENTE
; Justo SERRANO-VICENTE 
Complejo Hospitalario Universitario de Badajoz. Servicio de Medicina Nuclear. Badajoz. España.
Correspondencia: jirayo@gmail.com
Fecha de recepción: 14 de noviembre de 2021
Fecha de aceptación: 16 de diciembre de 2021
Fecha de publicación: 22 de diciembre de 2021
Fecha de publicación del fascículo: 22 de junio de 2022
Conflicto de intereses: Los autores declaran no tener conflictos de intereses
Imágenes: Los autores declaran haber obtenido las imágenes con el permiso de los pacientes
Política de derechos y autoarchivo: se permite el autoarchivo de la versión post-print (SHERPA/RoMEO)
Licencia CC BY-NC-ND. Licencia Creative Commons Atribución-NoComercial-SinDerivar 4.0 Internacional
Universidad de Salamanca. Su comercialización está sujeta al permiso del editor
RESUMEN: El hiperparatiroidismo primario (HPTP) es la principal causa de hipercalcemia en pacientes no hospitalizados, estando causado en el 85-90% de los casos por un adenoma solitario. La cirugía radioguiada de paratiroides (CRGP), como técnica GOSTT (Guided intraOperative Scintigraphic Tumor Targeting), utiliza la SPECT-TC con 99mTc-MIBI como técnica de elección. La PET-TC con 18F-Colina (18FCH) puede emplearse en pacientes con 99mTc-MIBI negativo, obteniéndose sensibilidades próximas al 95%. El uso de la 18FCH en la CRGP es muy complejo recomendándose la utilización de otros trazadores como los 99mTc-Macroagregados (99mTc-MAA) o las semillas de Yodo-125 (125I-Semilla). La CRGP disminuye el tiempo quirúrgico, los costes hospitalarios y la morbilidad sobre el paciente, con una elevada efectividad y eficiencia.
PALABRAS CLAVE: cirugía mínimamente invasiva; cirugía radioguiada; paratiroides; hiperparatiroidismo; Colina; PET-TC
SUMMARY: Primary hyperparathyroidism (PHPT) is the main cause of hypercalcemia in non-hospitalized patients, being caused in 85-90% of cases by a solitary adenoma. Radioguided parathyroid surgery (RGPS), as a GOSTT (Guided intraOperative Scintigraphic Tumor Targeting) technique, uses SPECT-TC with 99mTc-MIBI as the technique of choice. PET-TC with 18F-Choline (18FCH) can be used in patients with negative 99mTc-MIBI, obtaining sensitivities close to 95%. The use of 18FCH in CRGP is very complex, recommending the use of other tracers such as 99mTc-Macroaggregates (99mTc-MAA) or Iodine-125 seeds (125I-Seed). RGPS reduces surgical time, hospital costs and patient morbidity, with high effectiveness and efficiency.
KEYWORDS: minimally invasive surgery; radioguided surgery; parathyroid; hyperparathyroidism; Choline; PET-TC.
INTRODUCCIÓN
El hiperparatiroidismo (HPT) es una enfermedad endocrina caracterizada por una secreción excesiva de hormona paratiroidea (PTH), la cual regula los niveles de calcio, magnesio y fósforo en la sangre y hueso. El hiperparatiroidismo primario (HPTP) es la principal causa de hipercalcemia en pacientes no hospitalizados y es originado en el 85-90% de los casos por un adenoma solitario, en el 3-4% por adenomas múltiples, en el 5-10% por glándulas hiperplásicas y tan solo en el 1-2% por carcinomas de paratiroides [1,2]. Un 10% de los HPTP tienen un componente hereditario, ya sea como endocrinopatías aisladas o formando parte de los síndromes de neoplasia endocrina múltiple (MEN 1 y 2A) [3,4]. El hiperparatiroidismo secundario (HPTS) es una respuesta fisiológica a los cambios metabólicos que ocurren en pacientes con enfermedad renal crónica, malabsorción de vitamina D, metabolismo del fosfato, déficit de calcio, tratamiento con litio, etc. [5]. Un número significativo de estos pacientes desarrollan una hiperfunción paratiroidea autónoma patológica denominada hiperparatiroidismo terciario (HPTT) y que persiste incluso eliminada la causa del HPTS [6].
La Asociación Americana de Cirujanos Endocrinos (AAES) publicó en 2016 la Guía para el Manejo Definitivo del HPTP [7] y concluyó que la paratiroidectomía en el HPTP está indicada en todos los pacientes sintomáticos, debe considerarse para la mayoría de los pacientes asintomáticos y es más rentable que la observación o el tratamiento farmacológico. Son criterios quirúrgicos la elevación del calcio sérico de 1 ng/dl por encima del límite superior de la normalidad, una densitometría ósea con un Z-score menor de 2.5 desviaciones estándar, pacientes menores de 50 años, con síntomas óseos o lesiones líticas o con seguimiento difícil de su enfermedad. También señalan que es muy recomendable que el equipo quirúrgico realice al menos 10 paratiroidectomías al año.
Dado que el 85% de los pacientes con HPTP tienen su origen en un adenoma solitario, la paratiroidectomía resulta curativa, por lo que se han diseñado diferentes técnicas quirúrgicas cuyo fin es reducir la morbilidad y el riesgo de complicaciones, denominándose paratiroidectomía mínimamente invasiva (PMI). A este grupo de técnicas pertenecen la exploración unilateral del cuello, la cirugía endoscópica video asistida y robótica y la cirugía radioguiada de paratiroides (CRGP) y todas ellas requieren técnicas de imagen previa para determinar la región a abordar [7-10].
CIRUGÍA RADIOGUIADA
La Medicina Nuclear es una especialidad médica que emplea medicamentos radiofármacos para la prevención, investigación, diagnóstico y tratamiento de un amplio abanico de enfermedades [11]. Tiene tres vertientes claramente definidas y relacionadas entre sí y que son el diagnóstico por la imagen, el tratamiento metabólico y la cirugía radioguiada (Figura 1).
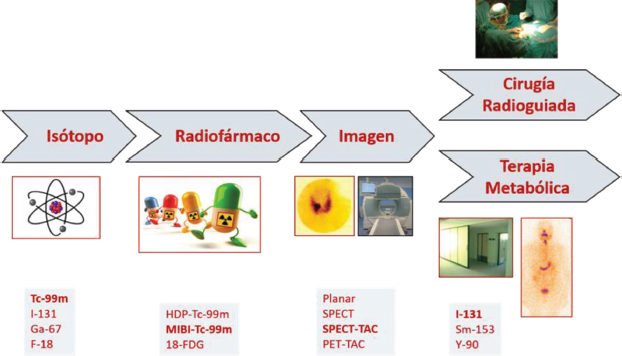
Figura 1. La especialidad de Medicina Nuclear.
La cirugía radioguiada (CRG) es una técnica quirúrgica mínimamente invasiva que emplea dichos radiofármacos para facilitar la localización y extirpación de lesiones benignas o malignas. Esta técnica se incluye dentro de las técnicas GOSTT (Guided intraOperative Scintigraphic Tumor Targeting), las cuales constan de dos fases. Una primera fase, preoperatoria, en la que se administra un radiofármaco y se realiza un estudio de imagen (gammagrafía, tomografía de emisión de positrones). Otra segunda fase intraoperatoria en la que, mediante un equipamiento específico de CRG, se localiza y extirpa la lesión captante del radiofármaco [12,13].
La evolución de las técnicas de imagen en Medicina Nuclear, desde las imágenes planares (gammagrafía con o sin pinhole), tomográficas (SPECT) o híbridas como la SPECT-TC, PET-TC e incluso la PET-MRI han mejorado notablemente el diagnóstico y la localización preoperatoria de las lesiones [13-16].
También hemos asistido al desarrollo de nuevas sondas intraoperatorias de CRG, que incluyen gammacámaras y dispositivos SPECT portátiles, herramientas de navegación, integración con sistemas robóticos laparoscópicos, etc. [13,17-20].
Por todo ello, desde 1956 en que Harris et al. [21] emplearon por primera vez la CRG para la detección de restos tiroideos hasta nuestros días, las indicaciones e importancia de la técnica no han dejado de crecer, destacando su uso en la patología mamaria, melanoma, cáncer de cabeza y cuello, tumores ginecológicos y urológicos, tumores digestivos y neuroendocrinos, adenomas de paratiroides, osteomas osteoides, etc. [22-30].
CIRUGÍA RADIOGUIADA DE PARATIROIDES
Como dijimos anteriormente, la CRGP como técnica GOSTT [12,13] y mínimamente invasiva [7-10] precisa de una técnica de imagen que permita localizar anatómicamente la lesión y establecer su comportamiento funcional. Posteriormente, emplearemos la afinidad del radiofármaco por la lesión a extirpar para localizarla en el quirófano.
Por lo tanto, existirán una serie de pasos bien definidos que desarrollaremos a continuación.
IMAGEN DIAGNÓSTICA O PREOPERATORIA
Esta información es aportada por las técnicas de imagen de Medicina Nuclear, a través de los estudios gammagráficos convencionales (gammagrafía o SPECT) o la PET y especialmente por las exploraciones híbridas como la SPECT-TC, PET-TC y PET-MRI [13-16]. Otros estudios de imagen como los ultrasonidos [31], la tomografía computarizada multifase o en cuatro dimensiones (TC-4D) [32] y la MRI convencional [33] complementan la información, pero no pueden emplearse de forma rutinaria durante la intervención quirúrgica.
Existen diversos procedimientos de Medicina Nuclear (uno o dos radiotrazadores, una o dos fases, con o sin sustracción de imágenes, con o sin imagen hibrida, etc.) pero la técnica de elección es el uso del 99mTc-MIBI asociado a la tecnología SPECT-TC, que ha supuesto un salto cualitativo muy importante, al emplear un isotopo de alto flujo fotónico (mejor calidad de imagen) y corto periodo de semidesintegración (menor dosimetría del paciente). Además, el radiofármaco tiene un lavado tiroideo más rápido que el paratiroideo (mejor IL/F), lo que asociado a una mejor técnica gammagráfica (SPECT-TC), permite localizar con exactitud las paratiroides patológicas y su correlación con estructuras adyacentes. Con todo ello se obtienen sensibilidades superiores al 85% [34-38]. El protocolo habitual consiste en la realización de una gammagrafía planar a los 15 minutos de la inyección del radiofármaco, seguida de una SPECT-TC, adquiriéndose una nueva gammagrafía planar a las 2 horas. Mandal et al. [39] sugieren que realizar tan solo una SPECT-TC precoz a los 15 minutos es suficientemente sensible y específico, y que las imágenes de fase tardía podrían ser innecesarias. Además, la administración intravenosa del radiofármaco, su elevado IL/F paratiroideo, el fenómeno de lavado tiroideo y la permanencia de actividad paratiroidea suficiente para realizar una paratiroidectomía hacen que sea el trazador ideal para realizar la CRGP [40,41].
En aquellos pacientes con SPECT-TC con 99mTc-MIBI negativo se propone el uso de la PET-TC con 18FCH, obteniéndose sensibilidades superiores al 95% [42-47]. El uso del Fluor-18 (18F) con un periodo de semidesintegración de 109,8 minutos (casi 2 horas) frente a los 20,4 minutos del Carbono-11 (11C) hacen viable el uso de esta técnica en centros que no disponen de ciclotrón. Desde el punto de vista diagnóstico, elevado flujo de fotones de la 18FCH y la gran resolución de los tomógrafos PET permiten visualizar lesiones más pequeñas.
Las lesiones paratiroideas identificadas mediante PET-TC con 18FCH en segunda línea suelen ser pequeñas o estar profundamente asentadas o tener una interposición ósea, por lo que la menor resolución de la SPECT-TC y atenuación de los tejidos pueden contribuir a la negatividad de los resultados de las imágenes de 99mTc-MIBI [48].
En base a su mayor sensibilidad, hay autores que incluso proponen emplear esta técnica como primera línea diagnóstica, obviando la gammagrafía con 99mTc-MIBI y los ultrasonidos [49]. Conviene resaltar que la experiencia con la 18FCH es aún muy limitada y que la exploración no está exenta de falsos positivos, más que el 99mTc-MIBI, especialmente relacionados con ganglios linfáticos inflamatorios o granulomatosos.
EVALUACIÓN PREOPERATORIA
Una vez establecida la indicación quirúrgica y dentro del estudio preoperatorio del paciente es importante realizar una evaluación detallada de las cuerdas vocales, la voz y la deglución, dada la proximidad de las paratiroides al nervio laríngeo recurrente [8], ya que podría lesionarse durante la CRGP.
MARCAJE DE LAS LESIONES DETECTADAS MEDIANTE LA PET-TC CON 18FCH
Cuando las paratiroides patológicas captan 99mTc-MIBI el marcaje es muy sencillo, ya que el trazador se inyecta por vía intravenosa previo a la cirugía. Existen diversos protocolos, destacando los de Norman [50], Flynn [51], Rubello [52] y Ugur [53]. en los que la dosis del radiofármaco y el protocolo de CRG es muy variable. Así, la dosis de 99mTc-MIBI puede oscilar entre 1-25 mCi y el momento de la inyección previo a la cirugía entre 15-120 minutos. En nuestro medio empleamos, con buenos resultados, un protocolo mixto entre los anteriormente descritos. La gammagrafía diagnóstica y la intervención se realizan en días diferentes. La gammagrafía se realiza con dosis elevadas de 99mTc-MIBI (20 mCi) y la intervención con dosis bajas (4 mCi). El análisis previo de las imágenes, la programación quirúrgica y la coordinación entre los especialistas facilita la optimización del tiempo quirúrgico. La localización del adenoma o la cinética de captación del 99mTc-MIBI establecen el momento de la administración del trazador previo a la cirugía [54].
La 18FCH podría emplearse como trazador sistémico en la CRGP, pero tiene una serie de problemas inherentes al radiofármaco, como son la disponibilidad de la 18FCH (solo 1-2 días/semana), el periodo de semidesintegración (2 horas) y el transporte desde el Servicio de Medicina Nuclear al Bloque Quirúrgico, lo que complica la programación del quirófano. Además, hay problemas inherentes al equipamiento de CRG ya que la sonda necesita una colimación especial para el 18F que hace muy difícil su uso en el cuello, en paratiroides pequeñas o profundamente asentadas (Figura 2).

Figura 2. Sonda para la detección de 99mTc y sonda con colimador para la detección de 18F.
Por ello, pueden emplearse dos técnicas ROLL alternativas:
1. Guiado por ecografía o TC, marcaje de la lesión detectada en la PET-TC con 18FCH con una dosis trazadora de 1 mCi de 99mTc-MAA en un volumen de 0.1 ml [55]. Posteriormente se realizará una gammagrafía o SPECT-TC de control (Figura 3). El marcaje puede realizarse hasta 24 horas antes de la cirugía ya que el periodo de semidesintegración del 9mTc es de 6 horas. Al ser una dosis liquida, y si bien no es frecuente, puede existir movilización o difusión por planos de ella.
2. Guiado por ecografía o TC, marcaje de la lesión detectada en la PET-TC con 18FCH con una 125I-Semilla de tungsteno con una actividad de 0.1-0.3 mCi de 125I. Posteriormente se realizará una ecografía o CT de control. (Figura 4). El marcaje puede realizarse hasta 1 mes antes de la cirugía ya que el periodo de semidesintegración del 125I es de 60 días. Al ser una dosis sólida y encapsulada de unos 4.5 mm de tamaño la movilización es más difícil. El tungsteno no interfiere con los estudios de RMN. Por último, pueden detectarse a una profundidad superior a 10 cm, mientras que otros tipos de semillas existentes en el mercado (RADAR, magnética, RFID) solo se detectan a 4-6 cm. Son más baratas, lo que compensa la presencia de un especialista en Medicina Nuclear en las intervenciones [56-64]. (Figura 5)

Figura 3. Proceso de marcaje con 99mTc-MAA.

Figura 4. Proceso de marcaje con 125I-Semilla.
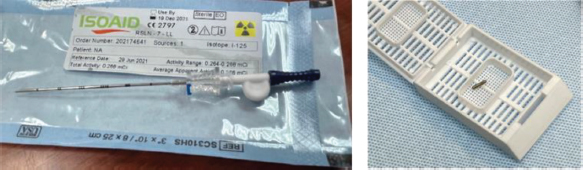
Figura 5. Aguja de 18G precargada con la 125I-Semilla y 125I-Semilla extraída.
INTERVENCIÓN QUIRÚRGICA
La programación del parte quirúrgico cuando se emplean 99mTc-MAA o 125I-Semilla no requiere tanta coordinación entre Servicios ya que estos trazadores, a diferencia del 99mTc-MIBI, tienen una nula cinética de lavado, por lo que no se ven influenciados por complicaciones y retrasos inesperados. Además, el índice lesión/fondo es mucho mayor, por lo que se reduce el tiempo quirúrgico.
Las imágenes gammagráficas planares, SPECT-TC o TC son revisadas por el equipo quirúrgico antes de iniciar la intervención. Se procede a la determinación de PTH preoperatoria.
La cirugía se realiza bajo anestesia general con intubación oro o nasotraqueal y ventilación asistida. Con el paciente en decúbito supino se favorece la exposición del cuello mediante la colocación de un rodillo almohadillado debajo de los hombros [65]. El médico nuclear localiza la máxima captación de 99mTc o 125I en cuello y realiza con un rotulador indeleble el marcaje cutáneo de la misma [54].
Tras la preparación del campo quirúrgico se procede a la incisión, disección y localización de la paratiroides patológica, guiado tanto por la experiencia quirúrgica del otorrinolaringólogo como por la información suministrada por la sonda de cirugía radioguiada (Figura 6).

Figura 6. Incisión sobre la zona de máxima captación detectada con el equipamiento de CRG.
Con el 99mTc-MIBI, las medidas obtenidas con la sonda en paratiroides, tiroides y fondo, se establecían diferentes índices de captación (paratiroides/tiroides o paratiroides/fondo) que permitían tomar decisiones quirúrgicas. Así, se empleaba la «regla del 20%» [50] o valores entre 2.5-4.5 para el índice paratiroides/fondo (IPT/F) [52] o valores superiores a 1.5 para el índice paratiroides/tiroides (IPT/T) en las glándulas patológicas [52].
Con los 99mTc-MAA o la 125I-Semilla, el índice lesión/fondo tiene valores muy elevados, lo que facilita su localización. El contaje oscila entre 5.000-15.000 cps, frente a los 250 cps del 99mTc-MIBI.
A los 10 minutos de la escisión del adenoma, se extraen muestras sanguíneas para la determinación de la PTH intraoperatoria. Un descenso del 50% de los valores de PTH en comparación con sus cifras preoperatorias constituye una prueba del éxito de la paratiroidectomía por HPTP [65,66]. La combinación de la imagen híbrida SPECT-TC o PET-TC, la sonda de CRG y la determinación intraoperatoria de PTH, aumenta en gran medida la precisión de la intervención y reduce considerablemente el tiempo quirúrgico.
Para Desiato et al [67] las ventajas de la CRGP son una elevada efectividad, con menor morbilidad, mejores resultados estéticos y hasta un 50% en la reducción de costes hospitalarios.
CONCLUSIONES
Como conclusiones podemos establecer que: 1º la SPECT-TC con 99mTc-MIBI es la técnica diagnóstica de elección en la patología paratiroidea. 2º La SPECT-TC con 99mTc-MIBI negativo no debe influenciar la indicación quirúrgica. 3º La PET-TC con 18FCH puede emplearse tras el SPECT-TC con 99mTc-MIBI negativo. 4º La Cirugía Radioguiada con 18FCH tiene muchas dificultades técnicas inherentes al radiofármaco y al equipamiento necesario en el quirófano, siendo los 99mTc-MAA (ROLL) o la 125I-Semilla (ROLLIS) la alternativa al 18FCH (ROLL). 5º Estos trazadores puede emplearse durante la CRGP que, mediante sondas intraoperatorias, gammacámaras y dispositivos SPECT portátiles, herramientas de navegación y sistemas robóticos laparoscópicos, dirigen en «tiempo real» la búsqueda de la lesión. 6º Por último, la CRGP disminuye el tiempo quirúrgico, costes hospitalarios y morbilidad, ofreciendo una elevada efectividad y eficiencia.
AGRADECIMIENTOS
Al Servicio de Otorrinolaringología del Complejo Hospitalario Universitario de Badajoz con quien comparto muy buenos momentos profesionales y personales en el desarrollo de la Cirugía Radioguiada.
BIBLIOGRAFÍA
1.Jiménez- Hoyuela JM, Rebollo AC, Miestre GI, Fernández C, Montañez E, Pinzón JL. Contribución de las técnicas de medicina nuclear al diagnóstico y localización del hiperparatiroidismo. An.Med.Interna. 2003; 20:137-40.
2.Udelsman R, Akerstrom G, Biagini C, Duh QY, Miccloi P, Niederle B, et al. The surgical management of asymptomatic primary hyperparathyroidism: proceedings of the fourth international workshop. J Clin Endocrinol Metab. 2014; 99:3395–606.
3.Pieterman CR, Schreinemakers JM, Koppeschaar HP et al. Multiple endocrine neoplasia type 1 (MEN1): its manifestations and effect of genetic screening on clinical outcome. Clin Endocrinol (Oxf).2009;70(4):575–81.
4.Wells Jr SA, Asa SL, Dralle H, et al. Revised American thyroid association guidelines for the management of medullary thyroid carcinoma. Thyroid. 2015;25(6):567–610.
5.Kidney Disease: Improving Global Outcomes (KDIGO) CKD-MBD Work Group. KDIGO clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD). Kidney Int Suppl. 2009;(113): S1–130. https://doi.org/10.1038/ki.2009.188.
6.Fraser WD. Hyperparathyroidism. Lancet. 2009;374(9684):145–58.
7.Wilhelm SM, Wang TS, Ruan DT, Lee JA, Asa SL, Duh QY, Doherty GM, Herrera MF, Pasieka JL, Perrier ND, Silverberg SJ, Solórzano CC, Sturgeon C, Tublin ME, Udelsman R, Carty SE. The American Association of Endocrine Surgeons Guidelines for Definitive Management of Primary Hyperparathyroidism. JAMA Surg. 2016 Oct 1;151(10):959-968.
8.Cox MD, Stack BC Jr. Minimally invasive radioguided parathyroidectomy. Stack BC Jr, Bodenner D (eds). Medical and Surgical Treatment of Parathyroid Diseases. An Evidence-Based Approach. Springer International Publishing. 2017.181-201. https://doi.org/10.1007/978-3-319-26794-4
9.Brunaud L, Li Z, Van Den Heede K, Cuny T, Van Slycke S. Endoscopic and robotic parathyroidectomy in patients with primary hyperparathyroidism. Gland Surg. 2016 Jun; 5(3): 352–360.
10.Arora A, Garas G, Tolley N. Robotic Parathyroid Surgery: Current Perspectives and Future Considerations. ORL J Otorhinolaryngol Relat Spec. 2018;80(3-4):195-203.
11.Ministerio de Sanidad, Consumo y Bienestar Social. Programas Formativos de Especialidades en Ciencias de la Salud. Medicina Nuclear. Programa elaborado por la Comisión Nacional de la Especialidad y aprobado por la Secretaría de Estado de Universidades e Investigación del Ministerio de Educación y Ciencia por Resolución de fecha 25 de abril de 1996. Disponible en: https://www.mscbs.gob.es/profesionales/formacion/guiaFormacion.htm
12.Valdés Olmos RA, Vidal-Sicart S, Giammarile F, Zaknun JJ, Van Leeuwen FW, Mariani G. The GOSTT concept and hybrid mixed/virtual/augmented reality environment radioguided surgery. Q J Nucl Med Mol Imaging. 2014 Jun;58(2):207-15.
13.Valdés Olmos RA, Vidal-Sicart S, Manca G, Mariani G, León-Ramírez LF, Rubello D, et al. Advances in radioguided surgery in oncology. Q J Nucl Med Mol imaging 2017; 61:247-70.
14.De Cicco C, Chinol M, Paganelli G. Intraoperative localization of the sentinel node in breast cancer: technical aspects of lymphoscintigraphic methods. Semin Surg Oncol. 1998 Dec;15(4):268-71.
15.Spanu A, Dettori G, Chessa F, Porcu A, Cottu P, Solinas P, Falchi A, Solinas ME, Scanu AM, Nuvoli S, Madeddu G. 99mTc-Tetrofosmin pinhole-SPECT (P-SPECT) and radioguided sentinel node (SN) biopsy and in breast cancer axillary lymph node staging. Cancer Biother Radiopharm. 2001 Dec;16(6):501-13.
16.Valdés Olmos RA, Rietbergen DD, Vidal-Sicart S, Manca G, Giammarile F, Mariani G Contribution of SPECT/CT imaging to radioguided sentinel lymph node biopsy in breast cancer, melanoma, and other solid cancers: from «open and see» to «see and open». Q J Nucl Med Mol Imaging. 2014 Jun;58(2):127-39.
17.Tiourina T, Arends B, Huysmans D, Rutten H, Lemaire B, Muller S. Evaluation of surgical gamma probes for radioguided sentinel node localisation. Eur J Nucl Med. 1998 Sep;25(9):1224-31.
18.Bluemel C, Matthies P, Herrmann K, Povoski SP. 3D scintigraphic imaging and navigation in radioguided surgery: freehand SPECT technology and its clinical applications. Expert Rev Med Devices. 2016;13(4):339-51.
19.Meershoek P, van Oosterom MN, Simon H, Mengus L, Maurer T, van Leeuwen PJ, Wit EMK, van der Poel HG, van Leeuwen FWB. Robot-assisted laparoscopic surgery using DROP-IN radioguidance: first-in-human translation. Eur J Nucl Med Mol Imaging. 2019 Jan;46(1):49-53.
20.Van Oosterom MN, Rietbergen DDD, Welling MM, Van Der Poel HG, Maurer T, Van Leeuwen FWB. Recent advances in nuclear and hybrid detection modalities for image-guided surgery. Expert Rev Med Devices. 2019 Aug;16(8):711-734.
21.Harris CC, Bigelow RR, Francis JE, Kelly GG, Bell PR. A Csl(Tl)-crystal surgical scintillation probe, Nucleonics.1956; 14 (102-108).
22.Sánchez Sánchez R, González Jiménez AD, Rebollo Aguirre AC, Mendoza Arnau I, Menjón Beltrán S, Vergara Alcaide ME, Osorio Ceballos JL, Llamas Elvira JM. 125I radioactive seed localization for non-palpable lesions in breast cancer. Rev Esp Med Nucl Imagen Mol. 2019 Jun 24. pii: S2253-654X(19)30010-1.
23.Perissinotti A, Rietbergen DD, Vidal-Sicart S, Riera AA, Olmos RAV. Melanoma & nuclear medicine: new insights & advances. Melanoma Manag. 2018 Jun 28;5(1):MMT06.
24.Giammarile F, Schilling C, Gnanasegaran G et al. The EANM practical guidelines for sentinel lymph node localisation in oral cavity squamous cell carcinoma. Eur J Nucl Med Mol Imaging. 2019 Mar;46(3):623-637.
25.Kessous R, How J, Abitbol J, Puzhakkal S, Kogan L, Yasmeen A, Salvador S, Gotlieb WH and Lau S. Triple tracer (blue dye, indocyanine green, and Tc99) compared to double tracer (indocyanine green and Tc99) for sentinel lymph node detection in endometrial cancer: a prospective study with random assignment International Journal of Gynecologic Cancer 2019;29:1121-1125.
26.Maurer T, Robu S, Schottelius M, Schwamborn K, Rauscher I, van den Berg NS, van Leeuwen FWB, Haller B, Horn T, Heck MM, Gschwend JE, Schwaiger M, Wester HJ, Eiber M. 99mTechnetium-based Prostate-specific Membrane Antigen-radioguided Surgery in Recurrent Prostate Cancer. Eur Urol. 2019 Apr;75(4):659-666.
27.Ankersmit M, Hoekstra OS, van Lingen A, Bloemena E, Jacobs MAJM, Vugts DJ, Bonjer HJ, van Dongen GAMS, Meijerink WJHJ. Perioperative PET/CT lymphoscintigraphy and fluorescent real-time imaging for sentinel lymph node mapping in early staged colon cancer. Eur J Nucl Med Mol Imaging. 2019 Jul;46(7):1495-1505.
28.El Lakis M, Gianakou A, Nockel P, Wiseman D, Tirosh A, Quezado MA, Patel D, Nilubol N, Pacak K, Sadowski SM, Kebebew E. Radioguided Surgery With Gallium 68 Dotatate for Patients With Neuroendocrine Tumors. JAMA Surg. 2019 Jan 1;154(1):40-45.
29.Suárez JP, Domínguez ML, de Santos FJ, González JM, Fernández N, Enciso FJ. Radioguided surgery in primary hyperparathyroidism: Results and correlation with intraoperative histopathologic diagnosis. Acta Otorrinolaringol Esp. 2018 Mar - Apr;69(2):86-94.
30.Vidal-Sicart S, Fuertes Cabero S, Danús Lainez M, Valdés Olmos R, Paredes Barranco P, Rayo Madrid JI, Rioja Martín ME, Díaz Expósito R, Goñi Gironés E. Update on radioguided surgery: from international consensus on sentinel node in head and neck cancer to the advances on gynaecological tumors and localization of non-palpable lesions. Rev Esp Med Nucl Imagen Mol. 2019 May - Jun;38(3):173-182.
31.Greenspan BS, Dillehay G, Intenzo C, Lavely WC, O’Doherty M, Palestro CJ, Scheve W, Stabin MG, Sylvestros D, Tulchinsky M. SNM practice guideline for parathyroid scintigraphy 4.0. J Nucl Med Technol. 2012;40(2):111–8.
32.Raghavan P, Durst CR, Ornan DA, Mukherjee S, Wintermark M, Patrie JT, et al. Dynamic CT for parathyroid disease: are multiple phases necessary? Am J Neuroradiol. 2014;35(10):1959–64.
33.Yousem DM. Parathyroid and thyroid imaging. Neuroimag Clin N Am. 1996; 6:435-42.
34.Gimlette TM, Taylor WH. Localization of enlarged parathyroid glands by thallium-201 y technetium 99m subtraction imaging. Gland mass and parathormone levels in primary hyperparathyroidism. Clin Nucl Med. 1985; 10: 235-9.
35.O’Doherty MJ, Kettle AG, Wells P, Collins REC, Coakley AJ. Parathyroid imaging with Technetium-99m- sestamibi: preoperative localization and tissue uptake studies. J Nucl Med. 1992;33(3):313–8.
36.Greenspan BS, Dillehay G, Intenzo C, Lavely WC, O’Doherty M, Palestro CJ, Scheve W, Stabin MG, Sylvestros D, Tulchinsky M. SNM practice guideline for parathyroid scintigraphy 4.0. J Nucl Med Technol. 2012;40(2):111–8.
37.Neumann DR, Obuchowski NA, DiFilippo FP. Preoperative 123I/99mTc-sestabimi subtraction SPECT and SPECT/CT in primary hyperparathyroidism. J Nucl Med. 2008;49(12):2012–7.
38.Wong KK, Fig LM, Gross MD, Dwamena BA. Parathyroid adenoma localization with 99mTc sestamibi SPECT/CT: a meta-analysis. Nucl Med Commun. 2015;36(4):363–75.
39.Mandal R, Muthukrishnan A, Ferris RL, de Almeida JR, Duvvuri U. Accuracy of early-phase versus dual phase single-photon emission computed tomography/computed tomography in the localization of parathyroid disease. Laryngoscope. 2015;125(6):1496–501.
40.Martinez DA, King DR, Romshe C, Lozano RA. Intraoperative identification of parathyroid gland pathology: a new approach. J Pediatr Surg. 1995;30(9):1306-9.
41.Norman J, Politz D. 5,000 Parathyroid operations without frozen section or PTH assays: measuring individual parathyroid gland hormone production in real time. Ann Surg Oncol. 2009;16(3):656–66.
42.Caldarella C, Treglia G, Isgro MA, Giordano A. Diagnostic performance of positron emission tomography using C-11-methionine in patients with suspected parathyroid adenoma: a meta-analysis. Endocrine. 2013 Feb;43(1):78-83.
43.Fernando N, Hindie E, Huggett S et al. Parathyroid scintigraphy: a technologist’s guide. Eur Assoc Nucl Med. 2006;1–43.
44.Broos WAM, Wondergem M, Knol RJJ, van der Zant FM. Parathyroid imaging with 18F-fluorocholine PET/CT as a first-line imaging modality in primary hyperparathyroidism: a retrospective cohort study. EJNMMI Research 2019; 9:72.
45.Boccalatte LA, Higuera F, Gómez NL et al. Usefulness of 18F-Fluorocholine Positron Emission Tomography-Computed Tomography in Locating Lesions in Hyperparathyroidism: A Systematic Review. JAMA Otolaryngol Head Neck Surg. 2019 May 30.
46.Huber GF, Hüllner M, Schmid C. et al. Benefit of 18F-fluorocholine PET imaging in parathyroid surgery. Eur Radiol 2018; 28: 2700.
47.Quak E, Blanchard D, Houdu B et al. F18-choline PET/CT guided surgery in primary hyperparathyroidism when ultrasound and MIBI SPECT/CT are negative or inconclusive: the APACH1 study. Eur J Nucl Med Mol Imaging. 2018 Apr;45(4):658-666.
48.Hindie E, Schwartz P, Avram AM et al. Primary Hyperparathyroidism: Defining the Appropriate Preoperative Imaging Algorithm. J Nucl Med 2021; 62:3S–12S. https://doi.org/10.2967/jnumed.120.245993
49.Broos WAM, Wondergem M, Knol RJJ et al. Parathyroid imaging with 18F-fluorocholine PET/CT as a first-line imaging modality in primary hyperparathyroidism: a retrospective cohort study. EJNMMI Res. 2019 Jul 31;9(1):72.
50.Norman J, Chheda H. Minimally invasive parathyroidectomy facilitated by intraoperative nuclear mapping. Surgery 1997; 122(6): 998-1004.
51.Flynn MB, Bumpouns JM, Schill K et al. Minimally invasive radioguided parathyroidectomy. Journal of the American College of Surgeons 2000 191: 24-31.
52.Rubello D, Piotto A, Casara D et al. Role of gamma probes in performing minimally invasive parathyroidectomy in patients with primary hyperparathyroidism: optimization of preoperative and intraoperative procedures. European Journal of Endocrinology, 2003; 149: 7-15.
53.Ugur O, Kara PO, Bozkurt MF et al. In vivo characterization of parathyroid lesions by use of gamma probe: comparison with ex vivo count method and frozen section results. Otolaryngol Head Neck Surg. 2006; 134: 316-20.
54.Rayo-Madrid, J. I., Martínez-Esteve, A., Infante De La Torre et al. Cirugía radioguiada de paratiroides. Revista ORL 2019; 11(3), 369–382. https://doi.org/10.14201/orl.21693
55.Aliyev A, Kabasakal L, Simsek O et al. Ectopic parathyroid adenoma localized with MIBI scintigraphy and excised with guide of macroaggregated human serum albumin injection. Clin Nucl Med. 2010 Mar;35(3):151-3.
56.Gray RJ, Salud C, Nguyen K et al..Randomized prospective evaluation of a novel technique for biopsy or lumpectomy of nonpalpable breast lesions: radioactive seed versus wire localization. Ann Surg Oncol 2001;8:711-5.
57.Lovrics PJ, Goldsmith CH, Hodgson N et al. A multicentered, randomized, controlled trial comparing radioguided seed localization to standard wire localization for nonpalpable, invasive and in situ breast carcinomas. Ann Surg Oncol. 2011;18:3407-14.
58.Alderliesten T, Loo CE, Pengel KE et al. Radioactive seed localization of breast lesions: an adequate localization method without seed migration. Breast J. 2011;17:594-601.
59.Sharek D, Zuley ML, Zhang JY et al. Radioactive seed localization versus wire localization for lumpectomies: a comparison of outcomes. AJR Am J Roentgenol. 2015;204:872-7.
60.van der Noordaa ME, Pengel KE, Groen E, et al. The use of radioactive iodine-125 seed localization in patients with non-palpable breast cancer. A comparison with the radioguided occult lesion localization with 99m technetium. Eur J Surg Oncol. 2015 Apr;41(4):553-8. https://doi.org/ 10.1016/j.ejso.2015.01.022.
61.de Danschutter S, Schreinemakers J, Kint P et al. Iodine 125 Seed for Localization in Primary Hyperparathyroidism. Surg Innov. 2016 Dec;23(6):593-597.
62.United States Nuclear Regulatory Commission. Iodine-125 and palladium-103 low dose rate brachytherapy seeds used for localization of non-palpable lesions [Internet] [citado 1 de abril de 2019]. Disponible en: https://www.nrc.gov/materials/miau/med-use-toolkit/seed-localization.html.
63.Mendoza Arnaua I, Sánchez Sánchez R, Culiánez Casas M, et al. Arpón quirúrgico vs. semilla de iodo (125I) en la localización de lesiones no palpables malignas de mama. Resultados preliminares. Radiología. 2020;62(1):38-45.
64.Sanchez Izquierdo, N. Semillas radioactivas frente a otros métodos de localización. Curso de Cirugía Radioguiada. Todo lo que debes saber sobre la cirugía radioguiada con 125I-Semillas.38 Congreso Nacional de la SEMNIM. Granada. Mayo. 2021.
65.Casas Rodera P, Galindo Delgado-Ureña J, Bernáldez Millán R. Cirugía de las glándulas paratiroides. Laringe y patología cérvico-facial. Libro virtual de formación en ORL. Capitulo 144. 1-14. Sociedad Española de Otorrinolaringología y Cirugía de Cabeza y Cuello (SEORL-CCC). Disponible en: https://seorl.net
66.Nussbaum SR, Thompson AR, Hutcheson KA et al. Intraoperative measurement of parathyroid hormone in the surgical management of hyperparathyroidism, Surgery 104 (1988) 1121-1127.
67.Desiato V, Melis M, Amato B, Bianco T, Rocca A, Amato M, Quarto G, Benassai G. Minimally invasive radioguided parathyroid surgery: A literature review. Int J Surg. 2016 Apr;28 Suppl 1:S84-93.