eISSN 2444-7986
DOI: https://doi.org/10.14201/orl.26043
ARTÍCULO ORIGINAL
PÉRDIDA DE AUDICIÓN TRAS GENTAMICINA INTRATIMPÁNICA EN LA ENFERMEDAD DE MÉNIÈRE. ESTUDIO RETROSPECTIVO
Hearing loss after intratympanic gentamicin in Ménière’s disease. Retrospective study
Cristina VILLAOSLADA-FUENTES; María José FERNÁNDEZ-NAVA; Sofía FERREIRA-CENDÓN; Rosana VILLAOSLADA-FUENTES; Hortensia SÁNCHEZ-GÓMEZ; Ángel BATUECAS-CALETRÍO
Servicio de Otorrinolaringología y Cirugía de Cabeza y Cuello del Complejo Asistencial Universitario de Salamanca.
Correspondencia: mjfernandeznava@hotmail.com
Fecha de recepción: 16 de marzo de 2021
Fecha de aceptación: 1 de mayo de 2021
Fecha de publicación: 3 de mayo de 2021
Fecha de publicación del fascículo: 1 de septiembre 2021
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
Política de derechos y autoarchivo: se permite el autoarchivo de la versión post-print (SHERPA/RoMEO)
Licencia CC BY-NC-ND. Licencia Creative Commons Atribución-NoComercial-SinDerivar 4.0 Internacional
Universidad de Salamanca. Su comercialización está sujeta al permiso del editor
RESUMEN
Introducción y objetivo: La enfermedad de Ménière (EM) se caracteriza por crisis de vértigo recurrentes acompañadas de acúfenos, pérdida de audición y sensación de plenitud ótica. Dentro de las opciones terapéuticas se hablará, entre otras, de inyección de gentamicina intratimpánica (ITG). El objetivo es evaluar la pérdida de audición tras la ITG en pacientes con EM. Método: Se estudiaron 33 pacientes con EM definitiva a los cuales se les administró ITG. Se valoró la pérdida de audición al mes de la ITG, a los 6, 12 y 24 meses. Resultados: De los 33 pacientes analizados, el 78,8% presentaban EM unilateral; el 21,2%, bilateral. El 48,5% fueron mujeres; el 51,5%, hombres. El 39,4% ya habían sido tratados con betahistina y corticoides. 9 pacientes presentaron crisis de Tumarkin antes de la ITG. Se comparó el PTA (Pure Tone Average) previo a la administración de ITG con el obtenido a los 2 años y la audición disminuyó de 57,50 dB a 62,58 dB. 9 pacientes precisaron una segunda tanda de ITG, con una pérdida de audición desde 66,72 dB a 68,96 dB. Y tras esto, 3 pacientes necesitaron una tercera tanda, pasando la audición de 63,75dB a 72,50 dB. Conclusiones: La utilización de ITG en la EM y provoca una caída del PTA de alrededor de 5 dB a expensas de una mejoría en la frecuencia e intensidad de las crisis de vértigo.
PALABRAS CLAVE
Enfermedad de Ménière; gentamicina; audiometría
SUMMARY
Introduction and objective: Ménière’s disease (MS) is characterized by recurrent vertigo attacks with tinnitus, hearing loss and aural fullness. Among the therapeutic options, intratympanic injection of gentamicin (ITG) will be discussed, among others. The objective is to evaluate hearing loss after ITG in patients with MS. Method: 33 patients of the Otorhinolaryngology and Head and Neck Surgery Service of the Hospital Clínico Universitario de Salamanca will be studied, all of them with definitive MS to whom ITG was administered. Hearing loss will be assessed one month after the ITG, at 6, 12 and 24 months. Results: Of the 33 patients analyzed, 78.8% had unilateral MS; 21.2%, bilateral. 48.5% were women; 51.5%, men. 39.4% had already been treated with betahistine and corticosteroids. 9 patients presented Tumarkin crisis before ITG. The PTA (Pure Tone Average) prior to ITG administration was compared with that obtained at 2 years and hearing decreased from 57.50 dB to 62.58 dB. 9 patients required a second round of ITG, with a hearing loss ranging from 66.72 dB to 68.96 dB. And after this, 3 patients needed a third wave, hearing from 63.75dB to 72.50 dB. Conclusions: The use of ITG in MS causes a fall in PTA of around 5 dB at the expense of an improvement in the frequency and intensity of vertigo attacks.
KEYWORDS
Meniere Disease; gentamicin; audiometry
INTRODUCCIÓN
Para diagnosticar la Enfermedad de Ménière (EM) es fundamental tener en cuenta los siguientes criterios: dos o más crisis de vértigo de mínimo 20 minutos, acúfenos unilaterales, hipoacusia neurosensorial unilateral fluctuante (en frecuencias < 2000Hz) documentada mediante audiometría en al menos una ocasión y sensación de plenitud ótica, excluyendo otras causas [1, 2]. Estos síntomas son intermitentes y variables en intensidad y duración [3]. Esta enfermedad se suele diagnosticar en torno a los 40-60 años y la incidencia es similar en ambos sexos [4].
Presenta una etiología multifactorial [5]. Se acepta que está causada por un desequilibrio entre la generación de endolinfa por la estría vascular del conducto coclear y la reabsorción de esta por el saco endolinfático [4]. A pesar de ello, esto no explica completamente las características clínicas de la enfermedad ni su evolución [6].
En el consenso que se elaboró en 2015 sobre los criterios diagnósticos de la EM, se valoran dos categorías: definitiva y probable [7].
Algunos pacientes sufren caídas sin pródromos y sin pérdida de conocimiento que duran varios segundos y que se conocen como crisis otolíticas de Tumarkin [8].
La terapia usada en la EM está enfocada en reducir la frecuencia y gravedad de las crisis de vértigo, con el menor deterioro posible de la audición [9]. Según el Consenso Internacional sobre el tratamiento, presentado en París [10], se contemplan varios escalones terapéuticos desde medidas generales hasta llegar a distintas opciones conservadoras o ablativas [10].
La primera línea de tratamiento sería médica conservadora con diuréticos, betahistina (fármaco que puede actuar mejorando el flujo sanguíneo hacia el oído interno [11]) y corticoides orales [12]. Si no se consigue el control de la enfermedad, se utilizarían corticoides intratimpánicos (ITC) [10]. Un tercer paso incluiría la cirugía del saco endolinfático (ELSS) si la audición está conservada [10].
Si el tratamiento conservador falla, se consideraría el tratamiento ablativo, dentro de ellos: la ITG, la laberintectomía y neurectomía vestibular (VN). Los tratamientos ablativos son usados preferentemente en pacientes con pérdida auditiva [10]. Está defendido un protocolo con inyecciones de ITG a 40mg/ml hasta la desaparición de los síntomas. La gentamicina actúa en el oído interno porque accede a él a través de las ventanas redonda y oval en su inyección [13] y produce pérdida de audición por la activación de mecanismos apoptóticos por radicales libres de oxígeno [14, 15]. La ototoxicidad aparece días o semanas después del tratamiento y es generalmente irreversible, inicialmente se afectan altas frecuencias. El riesgo de pérdida auditiva aumenta con el incremento de la dosis, la frecuencia de administración y la duración del tratamiento [16]. Si todo lo anterior fallase, se podría considerar la realización de técnicas como la laberintectomía quirúrgica o la VN [10].
El objetivo del estudio está en evaluar las repercusiones audiométricas a largo plazo del tratamiento con ITG.
MATERIAL Y MÉTODO
Población. Se ha realizado un estudio retrospectivo de una cohorte de 33 pacientes iniciales (29, con la pérdida de 4 de ellos para el estudio) diagnosticados de EM definitiva unilateral o bilateral, en el Servicio de Otorrinolaringología y Cirugía de Cabeza y Cuello del Complejo Asistencial Universitario de Salamanca. Los criterios diagnósticos de la EM definitiva son: dos o más episodios de vértigo espontáneo de entre 20 minutos y 12 horas de duración, hipoacusia neurosensorial de frecuencias medias y bajas documentada con audiometría en al menos un oído, definiendo el oído afectado en al menos una ocasión antes, durante o después de uno de los episodios de vértigo; síntomas auditivos fluctuantes en el oído afecto y exclusión de otro diagnóstico vestibular que explique los síntomas [5]. A todos los pacientes de nuestra cohorte se le ha administrado como mínimo una tanda de ITG, entendiendo por tanda al periodo dentro del cual se aplicaron un número variable de inyecciones de ITG separadas menos de un año cada una de ellas. En el caso de que este tiempo fuese superior, se habla de una nueva tanda de ITG. En la cohorte de este trabajo, la edad media de los 33 pacientes que se incluyeron en la muestra fue de 64,94 años (DE=12,44; mínimo=40 años, máximo=86 años, rango=46 años). La muestra siguió una distribución semejante en cuanto al sexo: 16 mujeres y 17 hombres. De los 33 enfermos, la mayoría cursaban con una EM definitiva unilateral (n=26) y tan solo 7 de ellos fueron diagnosticados de una EM definitiva bilateral. Además, 9 de los pacientes del estudio (27,3%) sufrieron crisis de Tumarkin.
Metodología de estudio. La dosis de ITG administrada ha sido de 0,4-0,5 mL (concentración de 20mg/ml). El número de inyecciones fue variable, dependiendo de la respuesta de cada enfermo, siempre separadas un mes entre sí. Se aplicó ITG a todos los pacientes que habiendo recibido previamente todos los tratamientos previos posibles no controlaron la sintomatología de la enfermedad y también a todos aquellos que sin ser necesario este requisito, sufrieron crisis de Tumarkin.
Variables. Se llevó a cabo un seguimiento de la evolución audiométrica mediante la comparativa de PTA (media de 500, 1000, 2000 y 4000Hz) de sus audiometrías tonales. El seguimiento audiométrico se realizó al mes, a los 6, 12 y 24 meses post-ITG, pero en este estudio se trabajará con los resultados a los 24 meses para realizar las comparaciones de acuerdo con el diseño del estudio. Además, se consideraron diferentes variables al realizar el análisis estadístico: edad, sexo, EM unilateral o bilateral, tratamientos previos, número de inyecciones de gentamicina y número de tandas de inyecciones de gentamicina.
Análisis estadístico. Se realizaron los siguientes estudios estadísticos mediante el programa informático SPSS (versión 25.0, IBM Company Inc, Chicago, Illinois). Se realizó una prueba de Kolmogorov-Smirnov (n>30) que se aplicó a las variables cuantitativas y todas ellas seguían una distribución normal, siendo susceptibles de pruebas paramétricas. Las variables cuantitativas se describieron con la media y la desviación estándar (DE) y se analizaron mediante una prueba de T de Student. Las variables cualitativas se analizaron mediante la prueba de Chi-cuadrado. Se estableció un nivel de significación de p<0,05. Y se fijó en 10dB el límite a partir del cual se objetivan diferencias significativas de pérdida de audición [2].
Ética. En la elaboración de este trabajo se han seguido los “Principios éticos para las investigaciones médicas en seres humanos” publicados por la Asociación Médica Mundial y recogidos en la Declaración de Helsinki de 2013 [17].
RESULTADOS
La ITG es un tratamiento médico ablativo que en esta muestra se plantea en aquellos pacientes donde las crisis de vértigo de la EM no son controladas con los tratamientos médicos conservadores. La dosis de la betahistina pautada en los pacientes es de 24mg cada 8 horas vía oral. El corticoide oral utilizado fue la prednisona, cuya dosis se ajustó al peso de cada paciente, estipulando un tratamiento a altas dosis durante 7 días, con posterior pauta descendente. La ITC se realizó con dexametasona, administrando entre 0.4-0.5mL. De los 33 pacientes, 13 de ellos fueron tratados previamente con betahistina, corticoide oral y corticoide intratimpánico. Un paciente no recibió tratamientos previos. El paciente que no recibió tratamientos previos sufría crisis de Tumarkin. En este recuento, tres pacientes se perdieron por falta de información. (Tabla 1).
El valor medio del PTA calculado en nuestra cohorte antes del tratamiento es de 57,50dB (DE=16,05, mínimo=16,25dB, máximo=83,75dB; rango=67,50). Calculamos el PTA previo y la mayoría de nuestros pacientes (n=29 pacientes, 87,88%) partían de un PTA previo al tratamiento ≥ 40dB, teniendo los 4 restantes un PTA <40dB antes de la ITG.
15 de estos pacientes (45,5%) solo recibieron una dosis de ITG en esta tanda. El número máximo de inyecciones de gentamicina administradas a un paciente en esta tanda fue de 7.
Calculando los PTA medios de la muestra de este trabajo a distintos puntos del seguimiento y comparándolos con el previo al tratamiento con gentamicina, objetivamos una caída del PTA de 57,50 dB a 62,58 dB a los 2 años, es decir, de 5,08 dB (Figura 1). 4 pacientes se perdieron por falta de datos, por lo que la PTA media calculada a los 2 años se calculó sobre 29 pacientes.

Figura 1. Evolución de PTA en la 1ª tanda de gentamicina intratimpánica.
No se halló relación estadísticamente significativa (p>0,05) entre la cifra audiométrica antes del tratamiento y la diferencia de dicha cifra con el PTA a los 2 años de la ITG (prueba ChiCuadrado), fijándose como límite 10dB [3].
La mayoría de los pacientes tenían un PTA ≥40 dB antes de la primera tanda con ITG. Al comparar la evolución del PTA a los dos años, no se encuentran diferencias estadísticamente significativas (p>0,05) entre los pacientes con un PTA <40dB o ≥40dB antes del tratamiento (prueba: T de Student para muestras independientes), fijándose como límite 10dB de diferencia [3].
De los 29 pacientes, el 27,3% necesitaron una segunda tanda de inyecciones. De esos 9 pacientes, el 44,4% recibió una dosis de ITG y 1 paciente necesitó 7.
Si se calcula el PTA medio antes de la segunda tanda de la ITG de estos 9 pacientes de la muestra, se objetiva un valor mayor (66,72dB) que el adjudicado al total de pacientes que solo necesitó una tanda (PTA previo=57,50dB; PTA tras 2 años de seguimiento=62,58dB). De los 9 pacientes, acabaron el seguimiento 6 de ellos, obteniéndose un PTA a los dos años de 68,96dB (Figura 2). En el caso concreto del paciente que requirió hasta 7 inyecciones de gentamicina en la segunda tanda para el control de su EM, el PTA medio cayó de 62,50dB a 78,75dB a los 24 meses.

Figura 2. Evolución de PTA antes y después de la 2ª tanda de gentamicina intratimpánica.
El 50% de los pacientes que fueron tratados con dos tandas de ITG necesitaron una tercera tanda. En estos pacientes su PTA pasó de 63,75 a 72,50dB (Figura 3).
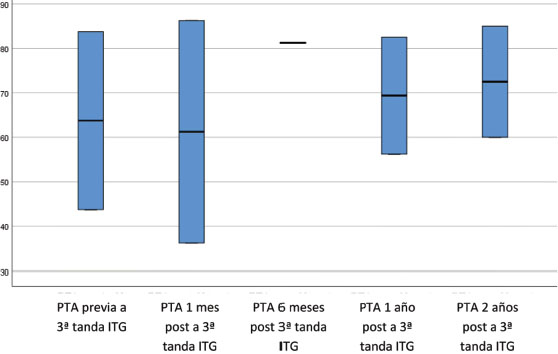
Figura 3. Evolución del PTA antes y después de la 3ª tanda de gentamicina intratimpánica
Variación de PTA en pacientes sometidos a una 2ª tanda de ITG (cohorte 1) frente a pacientes que recibieron una sola tanda (cohorte control).
Comparación de la variación de PTA entre pacientes que necesitaron un segundo ciclo de ITG, frente a aquellos que no precisaron más ciclos y cuya pérdida de audición se asimila a la correspondiente al resultado de la evolución natural de la enfermedad. Se mide la media de PTA en cada grupo tras un periodo de dos años tras finalizar la tanda de ITG y los resultados fueron:
• 20 pacientes no precisaron un segundo ciclo de ITG. La PTA media a los 2 años fue de 62,81dB.
• 9 pacientes precisaron un segundo ciclo de ITG. La PTA media a los dos años fue de 68,96dB.
La diferencia entre los pacientes en los que se puso una sola tanda de gentamicina frente a aquellos que recibieron una segunda es de 6,15dB, presentando una PTA mayor aquellos pacientes en los que se aplicó un segundo ciclo de ITG, pero este resultado no es estadísticamente significativo (p>0,05).
Variación de PTA en pacientes sometidos a una 3ª tanda de ITG (cohorte 2) frente a pacientes que recibieron una sola tanda (cohorte control)
Comparación de la variación de PTA entre la cohorte 2 y cohorte control. Se mide la media de PTA en cada grupo tras un periodo de dos años tras finalizar la tanda de ITG y los resultados fueron los siguientes:
• 20 pacientes no precisaron un segundo ciclo de ITG. La PTA media a los 2 años fue de 62,81dB.
• 3 pacientes precisaron un tercer ciclo de ITG, resultando válidos dos de los mismos. La PTA media a los dos años fue de 72,50dB.
La diferencia entre los pacientes en los que se puso una sola tanda de gentamicina frente a aquellos que recibieron un tercer ciclo es de 9,69dB, presentando una PTA mayor aquellos pacientes que recibieron una tercera tanda de ITG. Este resultado no es estadísticamente significativo (p>0,05).
DISCUSIÓN
En esta muestra contamos con 33 pacientes con EM que recibieron tratamiento con ITG. El 48,5% son mujeres y el 51,5%, hombres, es decir, la proporción de hombres y mujeres era similar, esto se corresponde con la afirmación de que el cuadro clínico suele afectar por igual a ambos sexos [2]. La edad media de este estudio es de 64,94 años (DE=12,44; mínimo=40 años, máximo=86 años, rango=46 años); sin embargo, la edad media del diagnóstico de la enfermedad es en torno a los 40-60 años [1, 18]. Esta diferencia se puede explicar por la selección que se ha hecho, siendo la mayoría de ellos pacientes con EM de muchos años de evolución, que son aquellos que suelen requerir tratamiento con gentamicina.
Se encuentran con más frecuencia pacientes con EM unilateral (78,79%), que pacientes con EM bilateral (21,21%). Havia [19] en su estudio describe una afectación bilateral en un 16% de los pacientes al diagnóstico, aumentando este porcentaje hasta un 44% en pacientes con más de 20 años de evolución de la enfermedad [20]. En este estudio el porcentaje de bilateralidad es mayor por la larga evolución de la enfermedad en estos pacientes.
Las crisis de Tumarkin se presentan en un 5%-6% de los pacientes que tienen diagnosticada la EM a lo largo de su evolución [20]. 9 de nuestros pacientes presentan crisis de Tumarkin, lo que representa un 27,27% del total, pero hay que tener en cuenta que los pacientes de este estudio han sido sometidos a una rigurosa selección previamente por haber sido tratados todos ellos con ITG. La ITG se considera de primera línea en un paciente con crisis de Tumarkin [20]. Debido a esto, y a que las mismas aparecen en pacientes con más años de progreso de la EM, el porcentaje de crisis de Tumarkin de nuestra muestra es superior.
El 39,4% de los enfermos recibieron todos los tratamientos previos posibles antes de la gentamicina, (betahistina, corticoides orales y corticoides intratimpánicos). No siempre fue así. Un paciente no recibió ningún tratamiento previo, esto se debe a que el mismo sufría crisis de Tumarkin y se trató directamente con ITG [20]. El 24,2% solo recibió betahistina previa, el 6,1% solo ITC y el 6,1%, ambas. En estos casos se suprimió el uso de corticoides orales posiblemente debido a contraindicaciones para su uso [21]. En los casos en que se usó solo betahistina o solo ITC se puede deber a que presentaron una gran pérdida auditiva o a que tuvieron crisis de Tumarkin.
Según Kaplan et al. [22], un PTA previo al tratamiento con gentamicina >40dB es el único factor de riesgo identificable para desarrollar hipoacusia tras la ITG. El 87,9% de los pacientes de nuestra cohorte superan esos 40dB. No hay relación estadísticamente significativa (p=0,928) entre la cifra audiométrica de PTA antes del tratamiento con la gentamicina (ya fuera mayor, menor o igual a 40dB), y la diferencia de dicha cifra con el PTA a los 2 años de tratamiento, fijándose como límite 10dB [3]. El tratamiento con ITG en pacientes con una PTA previa <40dB está justificado en pacientes con EM no resuelta con el manejo médico conservador y en quienes el vértigo es el síntoma más importante [12].
En el primer ciclo de tratamiento, 15 pacientes consiguieron controlar las crisis con 1 dosis de gentamicina, pero otros necesitaron hasta 7 dosis del fármaco. Hay varios factores que podrían explicar estas diferencias, la difusión de la medicación a la perilinfa depende de la permeabilidad y grosor de la membrana de la ventana redonda y de la dosis y concentración del fármaco en ese espacio [23]. También hay que considerar la farmacocinética de la sustancia, el método de aplicación, la sensibilidad individual al fármaco y la farmacodinamia del oído interno [23].
En la primera tanda de tratamiento se evalúa la PTA previa a la ITG, al mes post-ITG, a los seis meses y a los dos años. Se objetiva así una caída del PTA de 57,50dB (previa a la ITG) a 62,58dB (a los dos años), es decir, de 5,08dB. Pero no hay relación estadísticamente significativa (p>0,05). No hay consenso sobre la dosis y la duración del tratamiento intratimpánico con gentamicina [24]. En nuestro estudio, la ITG se ha administrado a demanda. Hay 15 enfermos con 1 inyección, 8 con 2, 5 con 3, 4 con 3, 1 con 5 y un último paciente con > 5 inyecciones, en concreto 7.
En este último paciente, se objetivó una caída del PTA previo al tratamiento con respecto al PTA a los 2 años post-ITG de 8,75dB, situándose por encima de los 5,08dB.
Un 31,03% de los pacientes precisaron un segundo ciclo de tratamiento con ITG. Gallardo Flores et al. [25] usaron dosis más bajas de gentamicina con el objetivo de conseguir alteración química sin esperar la aparición de signos de desaferentación. Obtuvieron un control total del vértigo en un 82% y significative en 12%. Tras dos años de seguimiento, el control total del vértigo fue de 74%, y fue significative en 11%, y a los cuatro años fue de 52 y 24%, respectivamente [25]. Pasados los años pueden volver a aparecer crisis, ya que las dosis que se usan no son ablativas totalmente y no se destruye por completo el sistema vestibular, con esto podemos explicar que parte de los enfermos precisaran una segunda tanda de ITG.
La PTA media de esta muestra tras el segundo ciclo de tratamiento con ITG se sitúa en 68,96dB, y por lo tanto se observa que ha habido pérdida de audición respecto a los 57,50dB de media de estos pacientes en el momento previo al tratamiento con ITG. Pero este resultado, ¿es debido a la ototoxicidad de la gentamicina o a la evolución natural de la EM? Para ello se comparó la PTA media a los 2 años de la primera tanda de ITG entre los pacientes que no recibieron más dosis de gentamicina (62,81dB) frente aquellos en los que se aplicó una segunda tanda (68,96dB) encontrando entre ambos una diferencia de 6,15dB, la cual no se considera estadísticamente significativa siendo esta <10dB que es el valor fijado por la AAO-HNS para considerarlo de interés [3]. Se concluye que la gentamicina no aumenta la pérdida auditiva.
Limitaciones del estudio. Podría contar este estudio con un sesgo ya que no se ha tenido en cuenta la dosis total administrada porque el número de inyecciones de ITG ha sido variable en las diferentes tandas. También se puede ver limitado el estudio por el reducido tamaño muestral y por la exposición a ITG, en este caso, el factor de estudio en la cohorte control.
CONCLUSIONES
El riesgo de disminución de la audición es un efecto secundario conocido de la ITG.
En esta cohorte, el tratamiento de la EM con una tanda de ITG provoca una caída del PTA en torno a 5dB a expensas de una mejora en la intensidad y frecuencia de las crisis de vértigo, con lo cual la ITG no supone un deterioro significativo de la audición.
La pérdida de audición aumenta en sucesivas tandas de ITG, hecho indistinguible de la disminución auditiva que de por sí ocurre en la evolución natural de la EM.
BIBLIOGRAFÍA
1. Acosta Egea S, Echeverría Miranda M, Salas Salas E. Enfermedad de Ménière en adultos. Revista Ciencia Y Salud. 2020;4(4):96-105. Disponible en: http://revistacienciaysalud.ac.cr/ojs/index.php/cienciaysalud/article/view/187/247 [Citado el 28 marzo 2021].
2. Wu IC, Minor LB. Long-term hearing outcome in patients receiving intratympanic gentamicin for Ménière’s disease. Laryngoscope. 2003;113:815–20.
3. Sam G, Wong Chung D, Van Der Hoeven R, Verweij S, Becker M. The effect of intratympanic gentamicin for treatment of Ménière’s disease on lower frequency hearing. Int J Clin Pharm. 2016;38(4):780–83.
4. Peñarrocha Terés J, Frágola Arnau C, Llavero Segovia MT, Rosell Cervilla A, Álvarez de Cózar F. Vértigo Periférico. En: Baragaño Río L. Manual del residente de ORL y patología cérvico-facial. XXIV. Madrid:IM&C;2002.841-42.
5. Lopez Escamez JA, Perez Carpena P. Current Understanding and Clinical Management of Meniere’s Disease: A Systematic Review. Semin Neurol. 2020;40(01):138-50. DOI: 10.1055/s-0039-340206.
6. Merchant SN, Adams JC, Nadol JB Jr. Pathophysiology of Ménière’s Syndrome: Are Symptoms Caused by Endolymphatic Hydrops?. Otol. Neurotol. 2005;206(01):74-81.
7. López Escámez JA, Carey J, Chung WH, Goebel JA, Magnusson M, Mandalà M et al. Criterios diagnósticos de enfermedad de Ménière. Documento de consenso de la Bárány Society, la Japan Society for Equilibrium Research, la European Academy of Otology and Neurotology (EAONO). Acta Otorrinolaringol Esp. 2016;67(1):1-7.
8. Morales Angulo C, Gallo Terán J. Crisis otolíticas de Tumarkin o drop attacks en pacientes con enfermedad de Meniere. Acta Otorrinolaringol Esp. 2005;56:469-71.
9. Bronstein A, Lempert T. Dizzines. A practical Approach to Diagnosis and Management. Chapter 4: Recurrent vértigo and dizziness. 79-83. 2ª edición. Cambridge. 2017.
10. Nevoux J, Barbara M, Dornhoffer J, Gibson W, Kitahara T, Darrouzet V. International consensus (ICON) on treatment of Ménière’s disease. Eur. Ann. Otorhinolaryngol. Head Neck Dis. 2018;135(1):S29-S32.
11. Murdin L, Hussain K, Schilder A. Betahistine for symptoms of vertigo. Cochrane Database of Systematic Reviews. 2016; 6. DOI: 10.1002/14651858.CD010696.pub2.
12. Victoria Bianchi M. Tratamiento de la Enfermedad de Ménière. Revista FASO año 22. Suplemento vestibular 1ª parte. 2015;71. Disponible en: http://faso.org.ar/revistas/2015/suplemento_vestibular/13.pdf [Citado el 9 feb 2021].
13. Schoo DP, Tan G, Ehrenburg MR, Pross SE, Ward BK, Carey JP. Intratympanic (IT) Therapies por Ménière’s Disease: Some Consensus Among the Confusion. Curr Otorhinolaryngol Rep. 2017;5(2):132-41.
14. Yetiçer S. Intratympanic Gentamicin for Intractable Ménière’s Disease - A Review and Analysis of Audiovestibular Impact. Int Arch Otorhinolaryngol. 2018;22:190-94.
15. Pérez Fernández N, García Purriños F. Enfermedad de Meniere: Ponencia Parte 4.2: Tratamiento de la EM. Tratamiento intratimpánico. 2009;265-72.
16. Edizer DT, Yigit O, Cinar Z, Gul M, Kara E, Yigitcan B, Hayir D, Atas A. Protective role of intratympanic nigella sativa oil against gentamicin induced hearing loss. International Journal of Pediatric Otorhinolaryngology. 2017;97:83-8.
17. Mastroleo I. Consideraciones sobre las obligaciones posinvestigación en la Declaración de Helsinki 2013. Rev. Bioética y Derecho [Internet]. 2014; (31): 51-65. Disponible en: http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1886-58872014000200005&lng=es [Citado el 9 feb 2021].
18. Pérez Garriguez H. Enfermedad de Ménière: aspectos clínicos. En: Pérez Garriguez H, López Escámez JA, Morales Angulo C, Pérez Fernández N. Enfermedad de Ménière: desde las ciencias básicas hacia la medicina clínica. Ponencia Oficial del LX Congreso Nacional de la Sociedad Española de Otorrinolaringología y Patología Cervicofacial. Badalona:Euromedice Ediciones Médicas SL;2009.115-24.
19. Havia M, Kentala E, Pyykko I. Hearing loss and tinnitus in Meniere’s disease. Auris Nasus Larynx. 2002;29(2):115-19
20. Pedro Cortez V, Homero Sariego R. Crisis otolítica de Tumarkin. Revisión de la literatura. Rev. Otorrinolaringol. Cir. Cabeza Cuello [Internet]. 2017;77(3):335-38. Disponible en: https://scielo.conicyt.cl/scielo.php?script=sci_arttext&pid=S0718-48162017000300335&lng=es [Citado el 9 feb 2021].
21. Cima.aemps.es [Internet]. [Actualizado sept 2017]. Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/58336/58336_ft.pdf [Citado el 9 feb 2021].
22. Kaplan et al. Hearing Loss Following Intratympanic Instillation of Gentamicin for the Treatment of Unilateral Meniere’s Disease. J OTOLARYNGOL-HEAD N. 2002;31:106.
23. Herraiza C, Aparicio JM, Plaza G. Vía intratimpánica en el tratamiento de patología de oído interno. Acta Otorrinolaringol Esp. 2010;61(3):225–32.
24. J.S. Philips, B. Westerberg. Intratympanic steroids for Ménière’s disease or síndrome. Cochrane Database Syst. Rev. 2011;7.CD008514.
25. Gallardo Flores MA, Ruiz Gonzales P, Vera Miaciro C. Gentamicina intratimpánica en dosis bajas para el control del vértigo en enfermedad de Ménière resistente al tratamiento médico. An Orl Mex. 2012;57(2). Disponible en: https://www.medigraphic.com/pdfs/anaotomex/aom-2012/aom122f.pdf [Citado el 9 feb 2021].