REVISTA DE LACTANCIA MATERNA, Vol. 1, 2023
eISSN: 3020-2469
DOI: https://doi.org/10.14201/rlm.30743
ARTÍCULO ORIGINAL
Restricción de crecimiento postnatal y asociación con lactancia materna exclusiva en menores de 1500 gramos
Postnatal Growth Restriction and Association with Exclusive Breastfeeding in Neonates with a Birthweight Less than 1500 Grams
Gabriela Bolea Muguruza1; Cristina de Frutos Martínez2; Laura Carlota García Miralles3; M.ª Teresa Tamayo Martínez4; Judith Martín Corral5
Unidad de Neonatología. Servicio de Pediatría. Hospital Universitario de Burgos.
Avenida Islas Baleares, 3. 09006 Burgos, España.
Financiación: Parte de los resultados componen un estudio financiado por el patronato de la Fundación “Ernesto Sánchez Villares” dentro de la “XXIV Convocatoria de ayudas a la investigación clínica y epidemiológica en pediatría”.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
Autor de correspondencia: Gabriela Bolea Muguruza (gabrielabmuguruza@gmail.com).
Fecha de envío: 24/10/2022. Fecha de aceptación: 6/06/2023. Fecha de publicación: 30/9/2023.
|
Palabras clave: recién nacido prematuro; recién nacido de muy bajo peso; restricción postnatal del crecimiento; lactancia materna |
RESUMEN Objetivo: Conocer la incidencia de restricción postnatal de crecimiento (RPC) en recién nacidos (RN) de muy bajo peso (peso al nacer <1500 g; RNMBP) de nuestra unidad, analizando el impacto del incremento de lactancia materna exclusiva (LME) y la introducción de leche donada (LD). Material y métodos: Estudio cuasi-experimental en RNMBP divididos en dos grupos respecto a una intervención para optimizar las prácticas de lactancia, incluyendo la disponibilidad de LD: grupo 1 (PRE-intervención; enero 2016-mayo 2018) y grupo 2 (POST-intervención; junio 2018-diciembre 2020). Se registran variables de somatometría al nacer, 28 días, 36 semana postmenstrual (sEPM) y alta, convirtiéndolas en z-score y percentil según estándares Intergrowth-21st. Se analiza la evolución de dichas variables y las posibles diferencias entre grupos. Resultados: Se incluyen 115 RNMBP con una mediana de edad gestacional de 29 semanas y peso 1235 g, 58 en grupo 1 y 57 en grupo 2. Encontramos diferencias significativas en las tasas de LME durante el ingreso entre ambos grupos (22.4 % vs. 61.4 %; p < 0.001) y al alta (39.7 % vs. 66.7 %; p = 0.004). Respecto a la RPC al alta, de forma global, un 31 % presentaba peso < p10 y 19 % perímetro cefálico < p10. Comparando ambos grupos, no hubo diferencias significativas en la RPC ni a las 36 sEPM (38.6 % vs. 33.9 %; p = 0.35) ni al alta (34.5 % vs. 28.1 %; p = 0.46). Conclusiones: la introducción de LD y el incremento de LME permiten preservar las tasas de crecimiento postnatal. Sin embargo, la prevalencia de RPC en RNMBP es relevante y consideramos necesario tratar de mejorar los resultados de crecimiento. |
|
Keywords: premature infants; very low birth weight infant; postnatal growth restriction; human milk |
SUMMARY Objetives: to define the incidence of postnatal growth failure (PGF) in very low birth weight infants (birth weight < 1500 g; VLBW), analyzing the impact of increasing exclusive human milk rates and the use of donor milk. Material and methods: Quasi-experimental study in VLBW infants divided into two groups regarding an intervention to optimize breastfeeding practices, including the availability of donor milk: group 1 (PRE-intervention: January 2016-May 2018) and group 2 (POST-intervention: June 2018 -December 2020). Weight, length and head circumference were recorded at birth, 28 days postnatal, 36 weeks of postmenstrual age and at discharge. Raw data were transformed into z-score and percentile in reference to Intergrowth-21st standards. The progress of these variables and the possible differences in both groups were analyzed. Results: The study included 115 VLBW infants with a median gestational age of 29 weeks and median birthweight of 1235 g, 58 in group 1 and 57 in group 2. We found significant differences in the rates of breastfeeding between both groups during admission (22.4 % vs. 61.4 %; p < 0.001) and at discharge (39.7 % vs. 66.7 %; p = 0.004). At hospital discharge, 31 % had a weight below p10 and 19 % had head circumference below p10. Comparing both groups, there were no significant differences in postnatal growth restriction either at 36 weeks postmenstrual age (38.6 % vs. 33.9 %; p 0.35) or at discharge (34.5 % vs. 28.1 %; p 0.46). Conclusions: The introduction of donor milk and the increase of exclusive breastfeeding allow preservation of postnatal growth rates. However, the prevalence of PGF in VLBW infants is relevant, and we consider it necessary to try to improve growth outcomes. |
1. INTRODUCCIÓN
El manejo nutricional de los recién nacidos prematuros (RNPT), especialmente aquellos de muy bajo peso al nacer (RNMBP; peso al nacimiento <1500 gramos) constituye uno de los principales retos de la neonatología actual. El tercer trimestre de gestación supone un periodo crítico en el crecimiento y desarrollo cerebral y, en el caso del RNPT, estos procesos de desarrollo tienen lugar en las unidades de cuidados intensivos neonatales (UCIN). De acuerdo con las recomendaciones del Comité de Nutrición de la Academia Americana de Pediatría (1977), los cuidados y la nutrición óptimos tras el nacimiento deberían permitir a los prematuros crecer de manera similar a como lo hace el feto intraútero (1).
La leche materna (LM) es el estándar de alimentación del recién nacido de alto riesgo, por sus propiedades biológicas, inmunológicas y nutricionales. Es el alimento de elección en cualquier recién nacido y, en especial, en los prematuros; en ellos disminuye el riesgo de enterocolitis necrotizante (NEC), sepsis, retinopatía del prematuro (ROP), displasia broncopulmonar (DBP) y muerte (2, 3). Además, mejora el neurodesarrollo y la salud cardiovascular a largo plazo (4). La alimentación con LM es la intervención sanitaria que, con menores costes económicos, consigue mayores beneficios sobre la salud del individuo (5). Es por ello una parte importante de la medicina materno-infantil, proteger, promover y apoyar la lactancia materna en los recién nacidos, especialmente aquellos de mayor riesgo (6). En ausencia de LM propia, la leche de madre donada (LD) es la alternativa de elección (7). Sin embargo, la LM por sí sola administrada a volúmenes habituales (150-180 ml/kg/día) es incapaz de cubrir las elevadas necesidades energéticas (110-135 kcal/kg/día) y nutricionales (aporte proteico 3.5-4 g/kg/día) del RNPT (8). Sabemos que la composición de LM varía en función de la edad gestacional, y posteriormente va cambiando a lo largo de las semanas con la edad postnatal (9). Aunque la leche producida por las madres que dan a luz prematuramente es más rica en proteínas (aporte proteico 2.7 g/100ml), este contenido disminuye progresivamente en las semanas posteriores al parto (hasta 1.1 g/100 mL en torno a las 4 semanas de vida) (10). Un aporte proteico deficiente en RNPT podría asociarse a una restricción postnatal del crecimiento (RPC). Para optimizar los aportes nutricionales en este grupo de población y con la finalidad de mejorar su crecimiento y desarrollo, se han diseñado fortificantes de LM que aportan energía, proteínas, minerales y vitaminas (11). Es práctica habitual en las unidades de neonatología el uso de estos suplementos, bien con una estrategia estándar o, de forma óptima, mediante una estrategia individualizada que ajusta el nivel de fortificación en función del análisis nutricional de la LM (fortificación específica) o de los niveles séricos de nitrógeno ureico o urea (fortificación ajustada) (12).
Sin embargo, y a pesar de las estrategias intensivas de nutrición en las unidades neonatales, los RNMBP experimentan durante su ingreso un déficit de crecimiento que puede tener consecuencias tanto a corto como a medio-largo plazo (13). El Instituto Nacional de Salud Infantil y Desarrollo Humano Eunice Kennedy Shriver (NICHD) informa que, a las 36 semanas de edad postmenstrual (sEPM), el 79 % de los RNMBP presentan RPC definida por un percentil de peso inferior al p10 (14). Por otro lado, en una cohorte española de 130 RNMBP se describe una prevalencia de RPC al alta del 59.2 % (15). Según los datos de la red SEN 1500 (años 2016-2020) el 70-73 % RNMBP tienen un peso inferior al percentil 10 a las 36 sEPM.
Un problema al que nos enfrentamos es que no existe consenso sobre cómo monitorizar el crecimiento de los RNPT (16), especialmente aquellos de muy bajo peso al nacer, que son, a su vez, el grupo de prematuros con mayor riesgo de sufrir alteraciones del crecimiento. Las dudas surgen en dos direcciones: qué estándares de referencia utilizar como normalidad y cuáles son los criterios para definir la RPC (17). Las tablas de monitorización que utilicemos (Fenton vs. Intergrowth-21st) así como la definición que adoptemos (definición estática, basada en un valor de percentil o z-score en un momento concreto vs. dinámica, basada en el crecimiento longitudinal) influirán en la prevalencia de RPC (18). Tanto es así que un estudio publicado en 2021 por el grupo del Hospital Central de Asturias describe diferencias en la prevalencia de RPC al alta que van desde porcentajes del 29.3 % (utilizando definición dinámica, con estándares Intergrowth-21st) hasta el 73.8 % (utilizando definición estática, con estándares Fenton) en una misma cohorte de RNMBP (17). Independientemente de la definición utilizada, podemos afirmar que la RPC es un problema común en las unidades neonatales. Por ello resulta importante recordar las repercusiones que tiene en el desarrollo neurológico la desnutrición postnatal (19, 20). Ehrenkranz et al. estudiaron a un grupo de 600 RNMBP y observaron cómo, a medida que aumenta el percentil de peso al alta, la incidencia de parálisis cerebral, exploración neurológica alterada y necesidad de rehospitalización disminuían significativamente (19). Por tanto, detectar de forma precoz alteraciones en el patrón de crecimiento y conocer los grupos de riesgo que requieran estrategias individualizadas de nutrición podría ayudarnos a mejorar los resultados de los prematuros a largo plazo (21). En los últimos años, algunos grupos han conseguido reducir las tasas de RPC gracias a estrategias de nutrición específicas (22). Un grupo de autores en Reino Unido analizan los patrones de crecimiento de casi 400 RNPT <32 semanas de gestación tras introducir un conjunto de medidas de mejora nutricionales; concluyen que la RPC no es inevitable y que, utilizando protocolos de nutrición específicos, se puede mantener un crecimiento postnatal en el percentil del nacimiento (23).
Nuestro objetivo principal es conocer la incidencia de RPC en los RNMBP (peso al nacer <1500 g) de nuestra unidad, analizando si el incremento de las tasas de LME y el uso de LD han tenido impacto sobre ello. Como objetivos secundarios buscamos detectar si algunas características basales, marcadores bioquímicos o complicaciones asociadas a la prematuridad pueden estar relacionados con la RPC. Con todo ello tratamos de establecer la base para poder iniciar mejoras en los protocolos de nutrición de nuestra unidad.
2. POBLACIÓN Y MÉTODOS
2.1. Diseño del estudio
Estudio cuasi-experimental en los RNMBP ingresados en nuestra unidad. El periodo de estudio fue de 5 años (2016-2020). El estudio fue aprobado por el Comité de Ética de Investigación del hospital.
2.2. Población de estudio
Se incluyen todos los RNMBP que ingresaron en la unidad durante el periodo de estudio. Se excluyeron los RN con síndromes genéticos o polimalformativos, los traslados de otro centro con más de 7 días de vida, los trasladados a otro centro antes de los 28 días de vida y los fallecidos.
Se dividió el conjunto de la población en dos grupos respecto a la intervención sobre las prácticas de LM: grupo 1 compuesto por los nacidos entre enero-2016 y mayo-2018 y grupo 2 con los nacidos entre junio-2018 y diciembre-2020.
2.3. Intervención
Entre 2017 y hasta junio 2018 se implementan en nuestra unidad una serie de medidas de eficacia conocida y demostrada por diversos estudios (24, 25, 26), para el aumento de las tasas de LME en los RNMBP. En junio de 2018 se introduce la LD en la unidad.
Entre las medidas introducidas para aumentar las tasas de LME, cabe resaltar:
– Formación mediante cursos y talleres del personal sanitario con atención directa a madres: médicos, matronas, enfermeras y auxiliares de partos, puerperio y neonatología, anestesistas, MIR de pediatría.
– Dotación de recursos materiales (extractores, neveras y congeladores).
– Información antenatal a gestantes con riesgo de parto prematuro.
– Implementación de la extracción precoz de calostro para su administración orofaríngea (protocolo específico).
– Potenciar el cuidado piel con piel frecuente y continuado.
– Información específica sobre lactancia para los padres de RN ingresados (elaboración de folletos y vídeos informativos).
– Monitorización de la lactancia durante el ingreso.
– Incorporar la evolución de la lactancia de cada niño en la rutina de las rondas de médicos y enfermeras.
2.4. Datos de crecimiento
Las variables de somatometría (peso, longitud y perímetro cefálico) se recogieron en valor absoluto y se convirtieron en z-score y percentil con respecto a los estándares Intergrowth-21st. El presente estudio analiza la evolución de dichas variables conforme a EPM, teniendo en cuenta cuatro momentos significativos: nacimiento, 28 días de edad cronológica, 36 sEPM y alta hospitalaria, así como las posibles diferencias entre ambos grupos. Se define RPC por un peso menor de p10 según los estándares de crecimiento postnatal del RN prematuro de Intergrowth-21st (27), valorado a las 36 sEPM y al alta, siendo esta última la variable principal de impacto.
2.5. Protocolo de nutrición
Nuestra unidad dispone de un protocolo de manejo nutricional del RNMBP que cumple en líneas generales las recomendaciones establecidas. Se inicia nutrición parenteral del primer día con aporte inicial de hidratos de carbono 6-8 g/kg/día, proteínas 2-2.5 g/kg/día y lípidos 1.5-2 g/kg/día, seguido de un aumento gradual de nutrientes durante la primera semana de vida. Desde 2017 disponemos de un protocolo específico de administración de calostro orofaríngeo (COF). La nutrición enteral trófica se inicia tan pronto como la estabilidad clínica del paciente lo permite, con LM propia preferiblemente; en el periodo preintervención (grupo 1) no se disponía de LD, por lo que, en ausencia de LM propia, se usaron fórmulas para prematuros. La LD se comenzó a utilizar en junio-2018. Se realizan incrementos de nutrición enteral de 20 ml/kg/día hasta alcanzar un volumen máximo de 160-180 ml/kg/día. La fortificación de LM se introduce al tolerar volúmenes de 100 ml/kg/día; en ambos periodos se utilizó fortificación multicomponente estándar. La utilización de módulo de proteína fue anecdótica durante el periodo de estudio. Así mismo, ningún sujeto del estudio recibió tratamiento con probióticos.
2.6. Variables clínicas
Se define LME como alimentación exclusiva con leche materna (propia y/o donada). Se define LM suplementada como alimentación con leche materna (propia y/o donada) y fórmula artificial. La lactancia materna al alta considera la alimentación recibida por el niño durante las últimas 24 horas de ingreso. Los fortificantes no se consideran suplemento, ya que se administran para alcanzar los objetivos nutricionales. Los criterios para adjudicar LD son los establecidos por el banco de leche regional: durante un máximo de 4 semanas a RN con peso al nacer inferior a 1500 g y un máximo de 6 semanas a RN con peso al nacer inferior a 1000 g. Por tanto, la indicación de LD finalizó antes del alta en todos los casos.
Se registró la presencia de complicaciones relacionadas con la prematuridad: enterocolitis necrotizante (NEC; estadio Bell ≥ 2), ductus arterioso persistente (DAP) con tratamiento farmacológico y/o quirúrgico, infección nosocomial y displasia bronco- pulmonar (DBP) moderada-grave. Para la definición de DBP se utilizó la clasificación del consenso del 2000 (28). Para el diagnóstico de sepsis nosocomial se utilizó la combinación de signos clínicos de infección con cultivo positivo de sangre y/o líquido cefalorraquídeo. Como parámetro bioquímico nutricional, se registró la urea sérica, a los 28 días de vida y en la 36 sEPM, considerando un valor inferior a 21 mg/dL como indicador de déficit nutricional proteico.
2.7. Análisis estadístico
Para el análisis, los datos se procesaron mediante el software estadístico IBM SPSS 19 v25. Se realizó un análisis descriptivo de la muestra aportando medias (desviación estándar), medianas (rango intercuartílico), frecuencia (porcentaje), según las características y distribuciones de las variables. Se evaluaron las posibles diferencias entre los dos grupos mediante las pruebas de la Chi-cuadrado (Fisher) para el caso de variables cualitativas y realizando la prueba t-Student (siempre que verifique condiciones de uso, en caso contrario, la prueba no paramétrica U de Mann-Whitney) si la variable es cuantitativa. Además, se aplicó un análisis de regresión lineal para determinar qué variables clínicas permiten predecir una caída significativa del z-score de peso y perímetro cefálico durante el ingreso. El nivel de significación estadística se estableció para p < 0.05.
3. RESULTADOS
Durante el periodo de estudio se incluyeron 115 RNMBP (54.8 % mujeres y 45.2 % hombres) con una mediana de edad gestacional de 29 semanas y peso 1235 g; no hubo diferencias significativas en cuanto a sus características perinatales, salvo para la gemelaridad, que fue más prevalente en el periodo PRE (Tabla 1). Con respecto a los resultados en lactancia, tras la intervención encontramos un aumento significativo en las tasas de LME durante el ingreso (22.4 % vs. 61.4 %; p < 0.001) y al alta (39.7 % vs. 66.7 %; p = 0.004) (Tabla 2). Observamos además una reducción significativa en la oclusión quirúrgica del DAP y sepsis nosocomial (tabla 3), así como una disminución, aunque no significativa, de la incidencia de NEC.
Respecto a la incidencia de RPC, se observa un incremento significativo en el porcentaje de RN con peso y/o perímetro cefálico (PC) inferior al percentil 10 (<p10) entre el nacimiento y las 36 sEPM, con cierta disminución posterior en las semanas previas al alta, coincidiendo con el periodo de mayor estabilidad clínica de estos prematuros. Al alta, de forma global, el 31 % presentaba peso <p10 y el 19 % un PC <p10. Comparando ambos grupos, la RPC a las 36 sEPM y al alta fue inferior en el grupo 2, tanto para valores de peso como de PC, pero sin significación estadística (Figura 1 y Figura 2). Así mismo, observamos una caída significativa de z-score de peso y PC entre el nacimiento y las 36 sEPM (p < 0.001). El periodo crítico para la caída de z-score de PC (periodo de mayor descenso de este) es entre el nacimiento y los 28 días de vida mientras que, para el peso, es entre los 28 días de vida y las 36 sEPM (Figura 3). Nuevamente no encontramos diferencias significativas entre grupos.
En el modelo de regresión lineal multivariado, la variable que permitió predecir una caída de z-score de peso y PC durante el ingreso fue un valor de urea <21 mg/dL a las 36 sEPM (p < 0.001); la sepsis nosocomial y la NEC también resultaron ser predictores negativos estadísticamente significativos de dicha caída de z- score (p = 0.049).
Tabla 1. Características generales de la muestra
|
Global |
GRUPO 1 |
GRUPO 2 |
p- valor |
|
|
N = 115 |
N = 58 |
N = 57 |
||
|
Características generales perinatales |
||||
|
EG (s; media ± DE) |
29.29 ± 2.6 |
29.05 ± 2.4 |
29.54 ± 2.7 |
0.861 |
|
EG (s; mediana, RIC) |
29 (27-31) |
29 (27-31) |
29 (28-31) |
0.912 |
|
Peso al nacer (g; media ± DE) |
1170 ± 264 |
1151 ± 261 |
1190 ± 267 |
0.759 |
|
Peso al nacer (g; mediana, RIC) |
1235 (975-1400) |
1200 (960-1390) |
1237 (989-1451) |
0.926 |
|
Varón (n, %) |
52 (45.2 %) |
26 (44.8 %) |
26 (45.6 %) |
0.978 |
|
Gestación gemelar (n, %) |
40 (34.8 %) |
26 (44.8 %) |
14 (24.6 %) |
0.023 |
|
Parto cesárea (n, %) |
76 (66.1 %) |
37 (63.8 %) |
39 (68.4 %) |
0.600 |
|
Apgar min. 5 (mediana, RIC) |
8 (7-9) |
8 (7-9) |
8 (6-9) |
0.226 |
|
CRIB 12 h de vida (mediana, RIC) |
1 (0-2) |
1 (1-2.75) |
1 (0-2) |
0.737 |
|
Ventilación mecánica (días, %) |
33 (28.7 %) |
18 (31.1 %) |
15 (26.3 %) |
0.576 |
|
Administración de surfactante (n, %) |
38 (33.1 %) |
24 (41.4 %) |
14 (24.6 %) |
0.055 |
|
Peso RN p < 10 (n, %) |
26 (22.6 %) |
12 (20.7 %) |
14 (24.6 %) |
0.832 |
|
PC RN < p10 (n, %) |
17 (14.8 %) |
8 (13.8 %) |
9 (15.8 %) |
0.796 |
EG: edad gestacional; RN: recién nacido; PC: perímetro cefálico.
Tabla 2. Prácticas de alimentación
|
Global |
GRUPO 1 |
GRUPO 2 |
p- valor |
|
|
N = 115 |
N = 58 |
N = 57 |
||
|
Lactancia materna durante todo el ingreso |
||||
|
LM exclusiva (n, %) |
48 (41.7 %) |
13 (22.4 %) |
35 (61.4 %) |
<0.001 |
|
LM suplementada (n, %) |
64 (55.7 %) |
42 (72.4 %) |
22 (38.6 %) |
<0.001 |
|
Lactancia materna al alta |
||||
|
LM exclusiva (n, %) |
61 (53.1 %) |
23 (39.7 %) |
38 (66.7 %) |
0.004 |
|
LM suplementada (n, %) |
27 (23.5 %) |
20 (34.5 %) |
7 (12.3 %) |
0.005 |
|
Uso de leche donada (n, %) |
43 (37.4 %) |
0 |
43 (75.4 %) |
<0.001 |
|
N.º de días con nutrición parenteral (mediana, RIC) |
6 (5-8) |
6 (5-8) |
6 (5.75-8) |
0.188 |
|
Días de vida tolera ENTERAL >140 ml/kg/día (mediana, RIC) |
9 (8-12) |
9 (8-12) |
9 (8-12.2) |
0.736 |
|
Días de vida inicio de FORTIFICACIÓN ESTÁNDAR, si LM (mediana, RIC) |
11 (10-14) |
10 (9-13) |
13 (10-14) |
0.056 |
|
Urea sérica < 21 mg/dL a los 28 ddv (%) |
71 (61.7 %) |
39 (67.2 %) |
32 (56.1 %) |
0.221 |
|
Urea sérica < 21 mg/dL a las 36 sEPM (%) |
69 (60.4 %) |
37 (63.6 %) |
32 (56.9 %) |
0.402 |
LM: leche materna; sEPM: semanas de edad postmenstrual.
Tabla 3. Complicaciones relacionadas con la prematuridad
|
Complicaciones relacionadas con la prematuridad |
||||
|
Global |
GRUPO 1 |
GRUPO 2 |
p- valor |
|
|
N = 115 |
N = 58 |
N = 57 |
||
|
Enterocolitis Bell ≥ II (n, %) |
5 (4.3 %) |
4 (6.9 %) |
1 (1.8 %) |
0.206 |
|
DBP moderada-grave (n, %) |
10 (8.7 %) |
5 (8.6 %) |
5 (8.8 %) |
0.977 |
|
DAP cierre farmacológico (n, %) |
17 (14.8 %) |
10 (17.2 %) |
7 (12.3 %) |
0.563 |
|
DAP oclusión quirúrgica (n, %) |
4 (3.5 %) |
4 (6.9 %) |
0 |
<0.001 |
|
Sepsis nosocomial (n, %) |
21 (18,3 %) |
15 (25,9 %) |
6 (10,5 %) |
0,031 |
DBP: displasia broncopulmonar; DAP: ductus arterioso persistente.
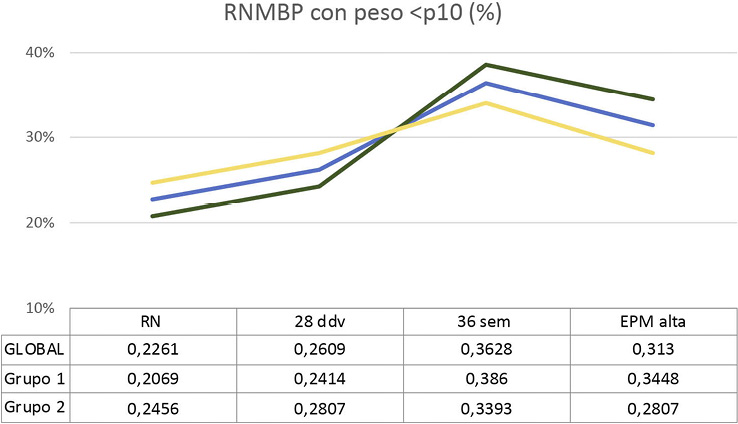
Figura 1. Evolución del porcentaje de RN con peso inferior a p10 durante el ingreso en la unidad

Figura 2. Evolución del porcentaje de RN con perímetro cefálico inferior a p10 durante el ingreso en la unidad
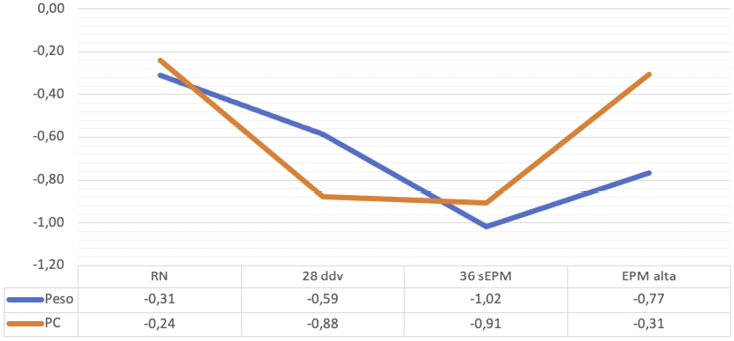
Figura 3. Evolución del z-score de peso y PC de los RN durante el ingreso
4. DISCUSIÓN
El presente estudio compara el patrón de crecimiento de una cohorte de 115 RNMBP y analiza las posibles diferencias en función de una intervención (aplicación de una serie de medidas para incrementar las tasas de LME e introducción de LD). Hemos observado una caída media de z-score tanto de peso como de PC de 0.7 puntos entre el nacimiento y las 36 sEPM. En esta línea, Sáenz de Pipaón et al. comunicaron en el año 2014 los resultados de un estudio prospectivo en una muestra de 111 neonatos <1.500 g y <34 semanas, y observaron un descenso de z-score de peso de 0,97 en las primeras 5 semanas (29). Posteriormente, en un trabajo liderado por García-Muñoz en 2017, se estudió la evolución posnatal del peso en una cohorte de 4520 neonatos de ≤28 semanas y observaron un descenso del z-score de peso de 1.7 puntos a las 36s EPM (30). En 2018, A. Ávila-Álvarez et al. analizan las tasas de RPC en 130 RNMBP y observan nuevamente una caída de 1 puntuación z de peso durante el ingreso hospitalario (15). Los resultados de estos tres estudios son muy similares al nuestro, y se sitúan en la línea de lo descrito de forma global en la literatura. Por otro lado, un estudio canadiense publicado en 2016 muestra cómo los prematuros sanos ajustan su trayectoria de crecimiento postnatal en -0.8 puntuaciones z por debajo de su percentil de crecimiento intrauterino después de su adaptación fisiológica inicial (31), lo cual podría ser considerado una transición natural de la trayectoria de crecimiento intrauterina a la extrauterina. Este dato justificaría los resultados de nuestro estudio; sin embargo, a las 36 sEPM casi un 40 % de los RNPT presentan un peso inferior al percentil 10, lo cual resulta alarmante. Analizando el patrón de crecimiento de los RNPT de nuestra muestra, observamos que el mayor descenso de z-score de peso se produce entre los 28 días de vida y las 36 sEPM. Esto ya había sido descrito previamente por Krauel en 2007, que habla de un aumento de la RPC entre los 28 días de vida y las 36 sEPM (32). Por otro lado, Embleton et al. encontraron en su cohorte de RNPT con edad gestacional inferior a 30 semanas una caída progresiva de z-score mantenida hasta las 5 semanas de vida (33). A partir de las 36 sEPM, en un periodo de mayor estabilidad clínica, se hace evidente una recuperación de crecimiento en los RNMBP de nuestro estudio, de tal manera que el porcentaje de RPC disminuye entre las 36 sEPM y el momento del alta hospitalaria.
Teniendo en cuenta el alto impacto en el neurodesarrollo que tiene un crecimiento postnatal subóptimo (19), consideramos que sería importante detectar aquellos recién nacidos de mayor riesgo nutricional, para poder establecer estrategias individualizadas de nutrición. Varios autores han analizado los factores que influyen en la RPC. Los estudios han demostrado que el riesgo aumenta con la disminución del peso al nacer y la edad gestacional (34). Otro factor para tener en cuenta es el déficit proteico que puede suponer la alimentación con LME sin un adecuado nivel de fortificación. Una revisión de la Cochrane en 2016 aborda el impacto de la fortificación estándar de la LM sobre el crecimiento y desarrollo de 1071 RNPT de 14 ensayos diferentes. Observan cómo la fortificación estándar de la LM, en comparación con la LM sin fortificar, mejora el incremento de peso durante el ingreso, así como del PC. Cuando se compara la LM fortificada de forma estándar frente a la fórmula para prematuros, los resultados indican que los prematuros alimentados con LM fortificada crecen más lentamente que los alimentados con fórmula (35). Por otro lado, Maas et al. analizaron el crecimiento de 206 RNPT y concluyeron que había un descenso estadísticamente significativo de peso entre el nacimiento y los 28 días de vida en los RNPT con una ingesta acumulada de LM superior al 75 %, en comparación con aquellos que tenían una ingesta de LM inferior al 25 %. La tendencia a una menor ganancia ponderal en los lactantes alimentados fundamentalmente con LM persistía en el momento del alta (36). Esto puede tener particular importancia si la LD representa un elevado porcentaje de la ingesta y obliga a plantearnos métodos de fortificación más adecuados.
En el presente estudio no hemos observado diferencias estadísticamente significativas en la incidencia de RPC tras el incremento de las tasas de LME y la introducción de LD. Por el contrario, la incidencia de RPC para peso y PC, así como el porcentaje de RNMBP con niveles de urea sérica por debajo del valor de 21 mg/dL, considerado como indicador de déficit proteico, fueron inferiores en el grupo 2, si bien no hubo significación estadística. Estos datos sugieren que el aumento de la LME con una estrategia de fortificación correcta permite mantener las tasas de crecimiento postnatal. Vázquez et al. también encontraron tasas de crecimiento preservadas al alta en un grupo de prematuros <32 s de edad gestacional tras la introducción de leche donada 37).
Por otro lado, sabemos que las complicaciones propias de la prematuridad, como la sepsis, NEC y la DBP, se correlacionan con tasas más altas de RPC entre los RNPT, en particular los de bajo peso al nacer (32). En nuestro estudio, el modelo de regresión lineal multivariado demostró que la sepsis nosocomial y la NEC fueron predictores negativos significativamente estadísticos de la caída de z-score (p valor 0.049). Pensamos, por tanto, que la disminución significativa de complicaciones (sepsis, NEC y DAP) en el grupo 2, probablemente relacionada con el incremento de las tasas de LME (38), ha contribuido a la mejora de las tasas de crecimiento de los RNMBP.
A pesar de todo, resulta importante destacar que más de un 30 % de los RNMBP de nuestra unidad tienen un percentil de peso inferior al p10 a las 36 sEPM y hasta un 40 % en el caso de PC. Todo esto nos obliga a poner en marcha estrategias de mejora dirigidas a optimizar la fortificación de LM, posiblemente avanzando hacia una fortificación individualizada, y a continuar trabajando para reducir las complicaciones asociadas a la prematuridad.
Como limitaciones del estudio podemos mencionar la ausencia de estandarización de las mediciones de peso, talla y perímetro cefálico. Cabe destacar además la introducción de forma paralela de otras estrategias de mejora desarrolladas en la unidad durante el periodo de estudio (medidas para reducir la incidencia de sepsis nosocomial) cuyo impacto concreto en la reducción de complicaciones es difícil de identificar. Finalmente, la baja incidencia de complicaciones ha podido limitar la obtención de ciertas asociaciones estadísticamente significativas. A destacar como puntos fuertes el diseño del estudio (cuasi-experimental), así como la homogeneidad de las prácticas clínicas entre neonatólogos, al tratarse de un estudio de un solo centro, con protocolos clínicos y nutricionales propios.
5. CONCLUSIONES
A modo de conclusión podemos afirmar que la introducción de LD y el incremento de la LME con un protocolo de fortificación adecuado permiten preservar las tasas de crecimiento postnatal. Sin embargo, la prevalencia de RPC en RNMBP continúa siendo relevante y consideramos necesario tratar de reducirla a través de protocolos de fortificación individualizada.
Sería interesante, de cara a futuro, realizar un seguimiento neurológico de los RNMBP que permita analizar la posible repercusión de los cambios en las prácticas de alimentación.
6. BIBLIOGRAFÍA
1. American Academy of Pediatrics Committee on Nutrition: Nutritional needs of low-birth-weight infants. Pediatrics. 1985;75(5):976-86.
2. Cacho NT, Parker LA, Neu J. Necrotizing enterocolitis and human milk feeding: A systematic review. Clin Perinatol [Internet]. 2017;44(1):49-67. Disponible en: http://dx.doi.org/10.1016/j.clp.2016.11.009
3. Patel AL, Johnson TJ, Engstrom JL, Fogg LF, Jegier BJ, Bigger HR et al. Impact of early human milk on sepsis and health-care costs in very low birth weight infants. J Perinatol [Internet]. 2013;33(7):514-9. Disponible en: http://dx.doi.org/10.1038/jp.2013.2
4. Victora CG, Bahl R, Barros AJ, França GV, Horton S, Krasevec J. Lancet Breastfeeding Series Group. Breastfeeding in the 21st century: epidemiology, mechanisms, and lifelong effect. Lancet. 2016;30:475-90.
5. Global breastfeeding investment case. The Investment Case for Breastfeeding: Nurturing the Health and Wealth of Nations. UNICEF, WHO; 2017.
6. The Baby-friendly Hospital Initiative for small, sick and preterm newborns. Geneva: World Health Organization and the United Nations Children’s Fund (UNICEF); 2020.
7. Moro GE, Arslanoglu S, Bertino E, Corvaglia L, Montirosso R, Picaud J-C et al. XII. Human milk in feeding premature infants: Consensus statement: Consensus statement. J Pediatr Gastroenterol Nutr [Internet]. 2015;61 Suppl 1(1):S16-9. Disponible en: http://dx.doi.org/10.1097/01.mpg.0000471460.08792.4d
8. Agostoni C, Buonocore G, Carnielli VP, Curtis D, Darmaun M, Decsi D. ESPGHAN Committee on Nutrition. Enteral nutrient supply for preterm infants: commentary from the European Society of Paediatric Gastroenterology, Hepatology and Nutrition Committee on Nutrition. J Pediatr Gastroenterol Nutr. 2010;50(1):85-91.
9. Gidrewicz DA, Fenton TR. A systematic review and meta-analysis of the nutrient content of preterm and term breast milk. BMC Pediatr [Internet]. 2014;14(1):216. Disponible en: http://dx.doi.org/10.1186/1471-2431-14-216
10. Ballard O, Morrow AL. Human milk composition: nutrients and bioactive factors. Pediatr Clin North Am [Internet]. 2013;60(1):49-74. Disponible en: http://dx.doi.org/10.1016/j.pcl.2012.10.002
11. Arslanoglu S, Moro GE, Ziegler EE. The Wapm Working Group On Nutrition. Optimization of human milk fortification for preterm infants: new concepts and recommendations. J Perinat Med. 2010;38(3):233-8.
12. Arslanoglu S, Boquien C-Y, King C, Lamireau D, Tonetto P, Barnett D. Fortification of human milk for preterm infants: Update and recomendations of the European Milk Bank Association (EMBA) Working Group on human milk fortification. Front Pediatr. 2019;7.
13. Cooke RJ, Ainsworth SB, Fenton AC. Postnatal growth retardation: a universal problem in preterm infants. Arch Dis Child Fetal Neonatal Ed [Internet]. 2004;89(5):F428-30. Disponible en: http://dx.doi.org/10.1136/adc.2001.004044
14. Ehrenkranz RA, Das A, Wrage LA, Poindexter BB, Higgins RD, Stoll BJ. Eunice Kennedy Shriver National Institute of Child Health and Human Development Neonatal Research Network. Early nutrition mediates the influence of severity of illness on extremely LBW infants. Pediatr Res. 2011;69:522-9.
15. Ávila-Álvarez A, Solar Boga A, Bermúdez-Hormigo C, Fuentes Carballal J. Restricción del crecimiento extrauterino en recién nacidos de menos de 1500 gramos de peso al nacer. Anales de Pediatría. 2018;89(6):325-32.
16. Villar J, Giuliani F, Barros F, Roggero P, Coronado Zarco IA, Rego MAS et al. Monitoring the postnatal growth of preterm infants: A paradigm change. Pediatrics [Internet]. 2018;141(2). Disponible en: http://dx.doi.org/10.1542/peds.2017-2467
17. González-García L, García-López E, Fernández-Colomer B, Mantecón-Fernández L, Lareu-Vidal S, Suárez-Rodríguez M et al. Extrauterine growth restriction in very low birth weight infants: Concordance between Fenton 2013 and INTERGROWTH-21st growth charts. Front Pediatr [Internet]. 2021;9:690788. Disponible en: http://dx.doi.org/10.3389/fped.2021.690788
18. Izquierdo Renau M, Aldecoa-Bilbao V, Balcells Esponera C, Del Rey Hurtado de Mendoza B, Iriondo Sanz M, Iglesias-Platas I. Applying methods for postnatal growth assessment in the clinical setting: Evaluation in a longitudinal cohort of very preterm infants. Nutrients [Internet]. 2019;11(11):2772. Disponible en: http://dx.doi.org/10.3390/nu11112772
19. Ehrenkranz RA, Dusick AM, Vohr BR, Wright LL, Wrage LA, Poole WK. Growth in the neonatal intensive care unit influences neurodevelopmental and growth outcomes of extremely low birth weight infants. Pediatrics [Internet]. 2006;117(4):1253-61. Disponible en: http://dx.doi.org/10.1542/peds.2005-1368
20. Ong KK, Kennedy K, Castañeda-Gutiérrez E, Forsyth S, Godfrey KM, Koletzko B et al. Postnatal growth in preterm infants and later health outcomes: a systematic review. Acta Paediatr [Internet]. 2015;104(10):974-86. Disponible en: http://dx.doi.org/10.1111/apa.13128
21. Stevens TP, Shields E, Campbell D, Combs A, Horgan M, La Gamma EF et al. Statewide initiative to reduce postnatal growth restriction among infants <31 weeks of gestation. J Pediatr [Internet]. 2018;197:82-89.e2. Disponible en: http://dx.doi.org/10.1016/j.jpeds.2018.01.074
22. Shlomai O, Reichman N, Lerner-Geva B, Boyko L, Bar-Oz V. Population-based study shows improved postnatal growth in preterm very-low-birthweight infants between 1995 and 2010. Acta Paediatr. 2014;103:498-503.
23. Andrews ET, Ashton JJ, Pearson F, Beattie RM, Johnson MJ. Early postnatal growth failure in preterm infants is not inevitable. Arch Dis Child Fetal Neonatal Ed [Internet]. 2019;104(3):F235-41. Disponible en: http://dx.doi.org/10.1136/archdischild-2018-315082
24. Meier PP, Johnson TJ, Patel AL, Rossman B. Evidence-based methods that promote human milk feeding of preterm infants: An expert review. Clin Perinatol [Internet]. 2017;44(1):1-22. Disponible en: http://dx.doi.org/10.1016/j.clp.2016.11.005
25. Lee HC, Kurtin PS, Wight NE, Chance K, Cucinotta-Fobes T, Hanson-Timpson TA et al. A quality improvement project to increase breast milk use in very low birth weight infants. Pediatrics [Internet]. 2012;130(6):e1679-87. Disponible en: http://dx.doi.org/10.1542/peds.2012-0547
26. Parker MG, Patel AL. Using quality improvement to increase human milk use for preterm infants. Semin Perinatol [Internet]. 2017;41(3):175-86. Disponible en: http://dx.doi.org/10.1053/j.semperi.2017.03.007
27. Villar J, Giuliani F, Fenton TR, Ohuma EO, Ismail LC, Kennedy SH. Consortium I-s. INTERGROWTH-21st very preterm size at birth reference charts. Lancet. 2016;387:844-5.
28. Jobe AH, Bancalari E. NICHD/NIH Workshop summary: bronchopulmonary dysplasia. Am J Respir Crit Care Med. 2001;163:1723-9.
29. Sáenz de Pipaón M, Martínez-Biarge M, Dorronsoro I, Salas S, Madero R, Martos GÁ et al. Growth in preterm infants until 36 weeks’ postmenstrual age is close to target recommendations. Neonatology [Internet]. 2014;106(1):30-6. Disponible en: http://dx.doi.org/10.1159/000358479
30. García-Muñoz Rodrigo F, Figueras Aloy J, Saavedra Santana P, García-Alix A. Crecimiento posnatal hasta el alta hospitalaria en recién nacidos extremadamente prematuros españoles. An Pediatr (Barc) [Internet]. 2017;87(6):301-10. Disponible en: http://dx.doi.org/10.1016/j.anpedi.2016.10.011
31. Rochow N, Raja P, Liu K, Fenton T, Landau-Crangle E, Göttler S et al. Physiological adjustment to postnatal growth trajectories in healthy preterm infants. Pediatr Res [Internet]. 2016;79(6):870-9. Disponible en: http://dx.doi.org/10.1038/pr.2016.15
32. Vidal K, Aloyb F, Pujolc N, Platasa I, Serrano M, Pérez C, Martín-Ancel F. Restricción posnatal del crecimiento en recién nacidos españoles de muy bajo peso con edad gestacional menor o igual a 32 semanas. Anales de Pediatría. 2018;68(3):206-12.
33. Embleton NE, Pang N, Cooke RJ. Postnatal malnutrition and growth retardation: an inevitable consequence of current recommendations in preterm infants? Pediatrics. 2001;107(2):270-3.
34. Clark RH, Thomas P, Peabody J. Extrauterine growth restriction remains a serious problem in prematurely born neonates. Pediatrics [Internet]. 2003;111(5 Pt 1):986-90. Disponible en: http://dx.doi.org/10.1542/peds.111.5.986
35. Hanigainathan S, Abiramalatha T. Early fortification of human milk versus late fortification to promote growth in preterm infants. Cochrane Database of Systematic Reviews. 2020;7:1057-68.
36. Maas C, Wiechers C, Bernhard W, Poets CF, Franz AR. Early feeding of fortified breast milk and in-hospital-growth in very premature infants: a retrospective cohort analysis. BMC Pediatr [Internet]. 2013;13(1):178. Disponible en: http://dx.doi.org/10.1186/1471-2431-13-178
37. Vázquez DC, García SS, Renau MI. Iglesias-Platas, I. Aviability of donor milk for very preterm infants decreased the risk of necrotizing enterocolitis without adversely impacting growth or rates of breastfeeding. Nutrients. 2019;11(8).
38. Boquien C-Y. Human milk: An ideal food for nutrition of preterm newborn. Front Pediatr [Internet]. 2018;6:295. Disponible en: http://dx.doi.org/10.3389/fped.2018.00295
