eISSN 2444-7986
DOI: https://doi.org/10.14201/orl.18244
Artículo original
RESULTADOS DE LA IMPLANTACIÓN COCLEAR EN EDAD PEDIÁTRICA. ESTUDIO RETROSPECTIVO EN 72 PACIENTES
Outcomes of cochlear implantation in pediatric age.
Retrospective study in 72 patients
Alejandro DIAZ-UÑA; Fernando BENITO-GONZALEZ; José Manuel GOROSPE-AROCENA
Complejo Asistencial Universitario de Salamanca. Servicio de Otorrinolaringología. Unidad de Implante Coclear Pediátrico. Salamanca. España.
Correspondencia: alexdebon3@gmail.com
Fecha de recepción: 26 de abril de 2018
Fecha de aceptación: 17 de mayo de 2018
Fecha de publicación: 19 de mayo de 2018
Fecha de publicación del fascículo: 15 de marzo de 2019
Conflicto de intereses: Los autores declaran no tener conflictos de intereses
Imágenes: Los autores declaran haber obtenido las imágenes con el permiso de los pacientes
Política de derechos y autoarchivo: se permite el autoarchivo de la versión post-print (SHERPA/RoMEO)
Licencia CC BY-NC-ND. Licencia Creative Commons Atribución-NoComercial-SinDerivar 4.0 Internacional
Universidad de Salamanca. Su comercialización está sujeta al permiso del editor
RESUMEN: Introducción y objetivo: Los grados profundo y severo de la deficiencia auditiva (DA) prelocutiva se consideran una discapacidad con importantes consecuencias en el desarrollo intelectual de los niños. En este escenario, el diagnóstico precoz y la atención temprana surgen como una solución efectiva. Método: Estudio retrospectivo longitudinal de 72 pacientes, implantados por debajo de los 14 años, y comparación de parámetros audiométricos antes y después de la cirugía, y estudio del desarrollo verbal tras 2 años post-intervención. Resultados: Se objetivó una ganancia audiométrica a los 2 años de la intervención de 62,79 dB (DE=14,86 dB) (p<0,05); resultados muy superiores a los obtenidos con el uso de audífonos. La mejora audiométrica no tuvo relación estadísticamente significativa con la edad del niño, pero sí con el tipo de implante. El desarrollo verbal del niño es mayor cuanto menor sea la edad de implantación (p<0,05). Discusión: Diversas sociedades y estudios colocan a los implantes cocleares (IC) como el tratamiento más eficaz de la DA severa-profunda y sus comorbilidades, avalando los resultados de nuestro estudio, al igual que ocurre con los estudios que demuestran que el desarrollo verbal es mejor si la implantación es temprana. Conclusiones: El IC obtiene unos resultados auditivos mejores que la estimulación audioprotésica, mejorando el pronóstico de la DA severa y profunda. La edad es fundamental en el desarrollo verbal (relación inversamente proporcional), no así en la ganancia auditiva. El análisis del desarrollo verbal según el tipo de implante mostró una distribución favorable a los IC bilaterales simultáneos (p>0,05).
PALABRAS CLAVE: Deficiencia auditiva; implante coclear; audífonos; niños; audiometría; desarrollo verbal.
SUMMARY: Introduction and objective: Severe to profound grades of the prelocutive auditory deficiency (AD) are considered a disability with significant consequences on intellectual development of children. In this context, early diagnostics and treatment arise as an effective solution. Method: Retrospective, longitudinal analysis of 72 implanted patients, younger than 14 years, and comparison of audiometric parameters before and after surgery, and analysis of verbal development at 2 years after intervention. Results: Post-surgical follow-up showed an audiometric gain at 2 years of 62,79 dB (SD=14,86 dB) (p<0,05); greater results to those obtained with the use of hearing aid. Audiometric improvement had no a statistically significant relationship with the child´s age, unlike with the kind of cochlear implant (CI). Verbal development of the child is inversely proportional to the lower the age of implant (p<0,05). Discussion: Different societies and studies placed to CI as the most effective treatment of the severe-profound AD, supporting the outcomes of our analysis, as so as occurring with those which show that verbal development is greater with earlier implantation. Conclusions: CI gets greater auditory outcomes that hearing aid, improving the prognostic of severe-profound AD. The age is essential in verbal development (inversely proportional relationship), but not in auditory gain. Analysis of verbal development according to the kind of CI showed a favorable distribution to simultaneous bilateral CIs (p>0,05).
KEYWORDS: Auditory deficiency; cochlear implant; hearing aid; children; audiometry; verbal development.
La capacidad de percepción auditiva, medida en decibelios (dB), representa el nivel más bajo del sonido al que un individuo puede oír. Una pérdida parcial o total de dicha capacidad es lo que denominamos deficiencia auditiva (DA). La DA puede clasificarse según diversos criterios, enumerados en la Tabla 1.
Tabla 1. Clasificación de la Deficiencia Auditiva (DA).
|
1. Según extensión: • Unilaterales. • Bilaterales. 2. Según localizacióna: • Conductiva o de transmisión: lesión de oído externo o medio (parte mecánica). • Neurosensorial o de percepción: lesión de oído interno. • Mixta. • Neuropatía auditiva: lesión a nivel nervioso de la vía auditiva. • Retrococlear: lesión del nervio auditivo secundaria a malformación o tumor. • Central: lesión en los centros auditivos cerebrales. 3. Según intensidadb: • Audición infranormal: pérdida auditiva inferior a 20 dB. • DA ligera: pérdida de entre 21 a 40 dB. • DA moderada: pérdida de entre 41 a 70 dB. • DA severa: pérdida de entre 71 a 90 dB. • DA profunda: pérdida de entre 91 a 120 dB. • DA total o cofosis: pérdida superior a 120 dB. 4. Según etiologíac: • Genéticas. Ø Aisladas (AR, AD, Ligadas al X). Ø Asociadas a otras malformaciones. • Adquiridas: Ø Prenatales: infecciones (TORCH), radiaciones, ototóxicos, enfermedades metabólicas maternas, hábitos tóxicos maternos (alcohol). Ø Perinatales: prematuridad, bajo peso, ventilación mecánica, hipoxia-isquemia perinatal, hiperbilirrubinemia, traumatismo craneal. Ø Postnatales: infecciones (otitis, laberintitis, meningitis, parotiditis, OMC), ototóxicos, ruidos, mastoiditis, fractura temporal, neuropatías. 5. Según momento de aparición. • Prelocutiva: previa a la adquisición del lenguaje (0 a ± 2 años). • Perilocutiva: durante la adquisición del lenguaje (≈ 2 a 4 años). • Postlocutiva: posterior a la adquisición de un lenguaje consolidado. |
|
a Moruno López E. Desarrollo del lenguaje en niños con implante coclear: diseño de un corpus y su aplicación al estudio de la fonología. Departamento de Filología Española, Italiana, Románica, Teoría de la Literatura y Literatura Comparada. Facultad de Filosofía y Letras. Universidad de Málaga; 2016. b Bureu International d´Audiophonologie (BIAP). c Manual básico de formación especializada sobre discapacidad auditiva. |
Según datos de la Organización Mundial de la Salud (OMS), la incidencia de la DA neonatal se sitúa en torno a 5/1000 recién nacidos (RN) vivos, siendo DA moderada en 3/1000 RN y DA severa o profunda en 1/1000 RN. En España, la incidencia de DA es de 7,69% (2,8/1000 RN vivos), y dentro de esta cifra, el 2,13% son DA de grado severo o profundo (0,77/1000) [1, 2]. Esto supone que cada año, en España, alrededor de 2000 familias tienen un RN con problemas en su audición, siendo unos 500 casos clasificados como DA profundas [1]. Además, se sabe que:
• Más del 95% de los niños y niñas sordos nacen en el seno de familias cuyos padres son normoyentes [3].
• Más del 40% de la población infantil con sorderas severas y profundas va a ser candidata a implante coclear (IC) [3].
• El 80% de las DA infantiles están presentes en el momento del nacimiento, según datos de la Comisión para la Detección Precoz de la Hipoacusia (CODEPEH) [3].
• En el 50% de los nacidos con DA se identifican factores de riesgo (Tabla 2) [3-5].
Tabla 2. Factores de riesgo del JCIHa (2007)4.
|
1. Sospecha de Deficiencia auditiva (DA) o de un retraso del desarrollo o en la adquisición del habla o del lenguaje. 2. Historia familiar de DA infantil permanente*. 3. Todos los niños, con o sin indicadores de riesgo, con un ingreso en UCIN mayor de 5 días, incluyendo cualquiera de lo siguiente: oxigenación extracorpórea*, ventilación asistida, antibióticos ototóxicos (gentamicina, tobramicina), diuréticos del asa (furosemida). Además, independientemente de la duración del ingreso, hiperbilirrubinemia que requiera exanguinotransfusión. 4. Infecciones intraútero como citomegalovirus*, herpes, rubéola, sífilis y toxoplasmosis. 5. Anomalías craneofaciales, incluidas aquellas que afectan al pabellón auditivo, conducto auditivo y malformaciones del hueso temporal. 6. Hallazgos físicos, como un mechón de cabello blanco frontal, que se asocian con un síndrome que incluye una sordera neurosensorial o transmisiva permanente. 7. Síndromes asociados con DA o sordera progresiva o de aparición tardía, como la neurofibromatosis*, la osteopetrosis* y el síndrome de Usher. Otros síndromes frecuentemente identificados incluyen el Waardenburg, Alport, Pendred y Jervell and Lange-Nielsson. 8. Enfermedades neurodegenerativas* como el síndrome de Hunter, neuropatías sensitivo-motoras, como la ataxia de Friedreich y el síndrome de Charcot-Marie-Tooth. 9. Infecciones posnatales asociadas con DA neurosensorial incluyendo meningitis bacteriana y vírica confirmadas (especialmente los virus herpes y varicela)*. 10. Traumatismo craneal, especialmente de base de cráneo o fractura temporal, que requiere hospitalización. 11. Quimioterapia*. |
|
a Joint Committee on Infant Hearing (JCIH). * Los indicadores de riesgo marcados están asociados con gran probabilidad de DA de desarrollo tardío. |
La percepción auditiva es la base para la adquisición del lenguaje y de diversas habilidades comunicativas. Por ello, cualquier trastorno de la audición, sobre todo a edades tempranas, afectará al desarrollo lingüístico, comunicativo y de otras áreas cognitivas, y, consecuentemente, a la posterior integración escolar, social y laboral [6-8].
El periodo crítico de aprendizaje es el intervalo de tiempo dentro del cual las estructuras corticales auditivas implicadas en el desarrollo del lenguaje deben recibir una adecuada estimulación, estableciéndose su mayor plasticidad hasta los 3,5 años aproximadamente [9, 10]. Tras él, quedan selladas las características morfológicas y funcionales de las estructuras neurológicas [11, 12], sentando las bases para una apropiación global y automática del lenguaje y del habla [6, 13, 14]. Por ello, el Joint Committee on Infant Hearing (JCIH) en su declaración de 2007 [4], promueve el acceso a pruebas de detección de la DA antes de un mes de edad (fase de cribado), una evaluación completa para confirmar el diagnóstico durante los tres primeros meses (fase de diagnóstico), y un inicio de tratamiento no más tarde de los seis meses (fase de tratamiento).
Es importante recordar que el cribado, exclusivamente basado en los factores de riesgo (JCIH, 2007 [4]), sólo identifica al 50% de los RN con una DA severa congénita [15]. En este sentido, el cribado auditivo universal posibilita dicho diagnóstico y un abordaje terapéutico global lo más precoz posible. En Castilla y León, el Programa de Detección Precoz y Atención Integral de la Hipoacusia Infantil se introdujo en todos los hospitales de la comunidad en el año 2004 [16], estableciéndose que los potenciales auditivos del tronco cerebral automáticos (PEATC-A) son ligeramente más efectivos que la combinación de otoemisiones acústicas (OEAT) y potenciales auditivos del tronco cerebral (PEATC) [16]. Si no pasa el cribado, se introduce al paciente en la fase de diagnóstico. En función del grado de pérdida auditiva, se inicia la fase de tratamiento que conlleva una terapia audioprotésica (con audífonos o IC) y una terapia auditivo-verbal.
La experiencia auditiva a través del IC puede ser capaz de suspender los efectos de la sordera en el cerebro, como el reclutamiento de las vías auditivas por parte de las vías visuales o el déficit sináptico de las estructuras de la vía dorsal auditiva (modelo neurolingüístico de la doble vía [17, 18]).
Un IC es un dispositivo electrónico que transforma los sonidos y ruidos ambientales en energía eléctrica capaz de actuar sobre las aferencias del nervio coclear y determinar así una sensación acústica. El paciente candidato a IC debe cumplir unas indicaciones, siendo los parámetros más importantes los criterios audiométricos (Tabla 3).
Tabla 3. Indicación de implante coclear (IC)
en la población infantil*.
|
1. Deficiencia auditiva (DA) neurosensorial bilateral de severa (pérdida auditiva 71-90 dB) a profunda (pérdida auditiva mayor de 90 dB) en niños de 5 hasta 17 años. En menores de 5 años solo DA bilaterales profundas. 2. DA prelocutiva, perilocutiva y postlocutiva. 3. DA sin beneficio o con mínimo beneficio con audífono tras un período de 3-6 meses. 4. Confirmación previa del beneficio que aportará el IC en la evaluación psicológica y neurológica. 5. Confirmación de viabilidad de inserción de los electrodos en la cóclea y la presencia del nervio coclear en estudios de imagen (TC, RNM o ambas). 6. DA en niños menores de 1 año de edad. |
|
*Referencia: Informe de Evaluación de Tecnologías Sanitarias AIAQS 2010/03. |
El seguimiento de los pacientes implantados incluye las revisiones periódicas por parte del otorrinolaringólogo y el foniatra, para valorar el buen funcionamiento y uso del dispositivo y la ganancia auditiva, trabajando, además, en el desarrollo de las competencias auditivas y verbales del niño, en busca de un nivel de audición, comprensión y lenguaje que se asemeje lo máximo posible al de un niño normoyente. Este progreso puede verse alterado por una serie de factores como la edad de implantación, el momento de aparición y duración de la sordera, la audición residual, el entorno familiar, el trabajo logopédico y educativo o el modo de comunicación, entre otros [9].
El objetivo de este estudio consiste en evaluar el desarrollo auditivo en una muestra de pacientes con deficiencia auditiva prelocutiva sometidos a una implantación coclear en el Complejo Asistencial Universitario de Salamanca. Así mismo, nos planteamos analizar si es real la asociación entre una implantación más precoz y un mejor resultado a nivel verbal (comprensión y expresión).
Estudio observacional y retrospectivo, de una cohorte de pacientes en edad pediátrica con una deficiencia auditiva neurosensorial (DANS) bilateral intervenidos para la colocación de un IC unilateral o bilateral, en la Unidad de Implante Coclear Pediátrico del Servicio de Otorrinolaringología del Complejo Asistencial Universitario de Salamanca, entre los años 2007 y 2016. Todas las intervenciones del estudio fueron realizadas por el mismo equipo quirúrgico.
La muestra objeto de estudio se compuso de 72 pacientes menores de 14 años, con una DANS severa (71-90 dB) y profunda (>90 dB). La edad de implantación está comprendida entre los 4 meses y los 12 años y 11 meses (con una media de 3 años y 1 mes y una desviación estándar [DE] de 34,32 meses).
Se realizó una valoración de la DA siguiendo los criterios de su definición y clasificación. En todos los sujetos de la muestra se registró en la medida de lo posible: edad cronológica y de implante, sexo, resultado del cribado auditivo, PEATC, potenciales evocados auditivos de estado estable (PEAEE) y audiometría tonal liminar (ATL) prequirúrgicos sin y con audífono; ATL a los 6 meses, 1 año y 2 años posimplante; test de bisílabas de Cárdenas-Marrero, test de percepción temprana de la palabra (ESP, por sus siglas en inglés) y el test PPVT-III (Peabody).
El análisis estadístico se realizó mediante el programa SPSS versión 23. Para ello, y tras comprobar que todas las variables siguen una distribución normal (prueba de Kolmogorov-Smirnov), las variables cuantitativas se presentan como la media y su desviación estándar (DE) y fueron analizadas mediante la prueba t de Student y el análisis de la varianza (ANOVA). Las variables cualitativas son presentadas como valor absoluto y se compararon mediante la prueba de Chi-cuadrado, estableciéndose un nivel de significación de p<0,05.
De los 72 pacientes de nuestra muestra, 35 eran niñas y 37 niños. A 17 de ellos no se les realizó cribado, mientras que de los 55 que sí lo tenían, 11 lo superaron.
El estudio de los PEATC en sendos oídos, realizado en 61 (84,7%) de los pacientes, mostró que, aproximadamente, un 65% no registraba actividad (onda V) a 95 dB, mientras que un 19,4% (14 pacientes) sí lo hacía.
Los PEAEE, obtenidos en 51 de nuestros pacientes, mostraron un umbral medio de 98,14 dB en OI (DE=10,86 dB) y de 99,02 dB en OD (DE=11,36 dB). Por su parte, la ATL sin audífonos prequirúrgica obtuvo unos resultados muy similares, con umbrales medios de 103,50 dB en OI (DE=11,51 dB) y 102,42 dB en OD (DE=11,77 dB).
Del total de pacientes, a 60 se les realizó ATL antes de la cirugía, mientras que 10 solo poseían PEAEE y 2 carecían de datos. A través de las pruebas audiológicas, los pacientes fueron clasificados entre DA severa (OI: 10 sujetos = 16,67%; OD: 15 sujetos = 25%) y DA profunda (OI: 50 sujetos = 83,3%; OD: 45 sujetos = 75%). De los 10 niños con PEAEE exclusivamente, 7 se clasificaron como DA profunda, 2 como DA severa y uno mostró una DA profunda en OI y moderada (41-70dB) en OD.
Con el uso de audífonos, los pacientes analizados (N=49) mostraron una mejoría auditiva en torno a 20 dB, encontrándose unos umbrales medios de 79,39 dB en OI (DE=23,11 dB) y de 81,63 dB en OD (DE=23,44 dB).
De los 72 pacientes, 27 de ellos (37,50%) fueron implantados antes de los 18 meses de edad, 22 (30,56%) entre los 18 y 36 meses y 23 (31,94%) después de los 36 meses de edad.
Respecto al IC, 34 pacientes (47,22%) fueron intervenidos unilateralmente y 38 (52,78%) bilateralmente, de los cuales 20 (27,78%) fueron simultáneos en el tiempo y 18 (25,00%) secuenciales. La tasa de reimplante fue del 9,72% (7 pacientes).
De la totalidad de IC colocados (N=111), 6 no pudieron ser evaluados. En el resto (N=105), obtuvimos unos niveles medios preintervención en torno a 104 dB (DE=10,77 dB), con un rango entre 70 y 120 dB.
El parámetro utilizado en nuestro estudio, para evaluar la posible mejora auditiva post-implante, fue la ATL a los 6 meses, 1 año y 2 años. A los 6 meses, la audición media obtenida se situó en 53,56 dB, suponiendo una ganancia auditiva de 50,72 dB (DE=21,01 dB). Al año, esta ganancia aumentó hasta los 58,35 dB (DE=17,76 dB), llegando a los 62,79 dB (DE=14,86 dB) a los 2 años de seguimiento. Estos resultados fueron estadísticamente significativos (p<0,05).
Comparando el beneficio audiométrico obtenido con el uso de audífonos y de IC, observamos que es mayor en el segundo caso, duplicando la capacidad auditiva (41 dB con IC, 85 dB con audífonos). Dicha ganancia resultó estadísticamente significativa (p<0,05).
Realizando un análisis de nuestra muestra según la edad de implante, se comprobó que la ganancia audiométrica fue de 64,33 dB en aquellos implantados después de los 36 meses de edad, frente a los 63,78 y 59,62 dB mostrados por los implantados antes de los 18 meses y entre los 18 y 36 meses, respectivamente. Dicha ganancia resultó estadísticamente significativa (p<0,05). En cambio, al comparar esta mejora audiométrica a los 2 años entre los diferentes grupos etarios, obtenemos que no hay diferencias significativas entre ellos (p>0,05).
Este mismo estudio, basado en la unilateralidad o bilateralidad del IC, mostró una mayor ganancia con el IC unilateral (64,50 dB), frente a los 61,98 dB del bilateral. Tanto la ganancia como la comparación entre sendos IC a los 2 años de la cirugía fue estadísticamente significativa (p<0,05).
Este análisis audiométrico fue complementado con una evaluación del desarrollo del lenguaje a través de la identificación de bisílabas (Listas de Cárdenas-Marrero), el test de percepción temprana de la palabra (ESP, por sus sílabas en inglés) y el Peabody PPVT-III.
Los resultados del test de bisílabos de Cárdenas-Marrero, mostró que el 80,43% (N=37) de los pacientes a los que se les realizó (N=46) identificaba más del 70% de bisílabas (nivel alto de identificación). Un 15,22% (N=7) se encuadró en niveles medios-altos, mientras que un 2,17% (N=1) identificaban un 30-49% (nivel medio-bajo) y 10-29% (nivel bajo). La comparativa de estos resultados, en función de la edad de implante y el lado del mismo, no mostró una mejor evolución estadísticamente significativa (p>0,05) en ninguno de los estratos, tanto etarios como por unilateralidad/bilateralidad del IC.
De nuestra muestra total de pacientes (N=72), a 40 de ellos (55,60%) se les realizó el test ESP. Los resultados de este mostraron una distribución categórica compuesta, mayoritariamente, por una identificación consistente de la palabra (categoría 4 de 4) (Figura 1).
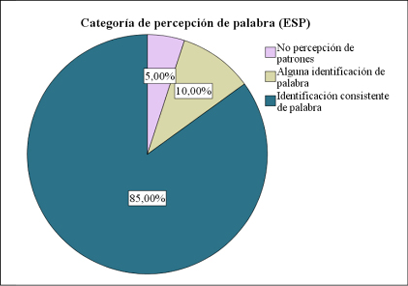
Figura 1. Distribución según categorías de percepción de palabra (ESP).
La comparativa de los valores obtenidos a partir de este test indicó que la mayor parte de los niños poseían una capacidad de identificación de palabra consistente, sin diferencias estadísticamente significativas (p>0,05).
Del total de la muestra, 28 pacientes (38,90%) superaron el test Peabody, mientras que de los restantes, 4 pacientes (5,60%) no lo hicieron y al resto (40 pacientes = 55,60%) no se les realizó.
Dentro de la muestra de pacientes que superaron el Peabody (N=28), observamos que aquellos implantados después de los 36 meses de edad (N=12) obtuvieron peores puntuaciones en comparación con los pacientes implantados antes de los 18 meses (N=11). Esta diferencia se demostró estadísticamente significativa al comparar los rangos etarios extremos (p<0,05). Sin embargo, el análisis comparativo con el rango entre 18 y 36 meses no demostró significación estadística en relación con los otros dos estratos (p>0,05).
En lo referente al desarrollo lingüístico de los pacientes implantados, al analizar cuál es la opción que muestra un mayor acceso a dicho desarrollo, observamos que, si bien la distribución parece favorecer a los implantes simultáneos, la diferencia no es estadísticamente significativa (p>0,05).
Dentro de las pruebas utilizadas para el cribado de la DA, los PEATC-A poseen una efectividad y eficiencia demostradas [16], al igual que la ATL usada en el seguimiento [19].
El desarrollo de algunas habilidades lingüísticas de los niños con IC parece que sigue una trayectoria diferente cuando se les compara con niños con sordera profunda sin implante, al igual que ocurre con algunas habilidades en comparación con niños normoyentes. Dicha trayectoria podría entenderse mejor si analizamos las relaciones existentes entre la señal acústica proporcionada por el IC, el proceso de percepción y las habilidades lingüísticas de los niños con IC. Dichas relaciones ayudarán a comprender cuál es el proceso que caracteriza el desarrollo del lenguaje de estos [9].
El uso de IC frente a audífonos ha sido ampliamente estudiado, concluyendo que ambos permiten una ganancia auditiva significativa [20-21]. Sin embargo, la implantación ofrece unos mejores resultados que los audífonos (Miyamoto y cols. [22], Manrique y cols. [23]), lo cual también se comprueba en nuestro estudio a través del análisis de las ATL medias con ambos dispositivos.
Se ha demostrado que los niños con un IC unilateral presentan mayores dificultades auditivas y de localización del sonido [24]. Existen diversos estudios que aseguran que la estrategia de estimulación bimodal (IC más audífono) [25], ha demostrado mayor discriminación del lenguaje en comparación con audífonos o un solo implante [21, 26-28]. Diferentes estudios han demostrado que la implantación bilateral presenta una mejora en la percepción del sonido en silencio [29], detección y percepción del discurso [30-32] e inteligibilidad en ruido [29] y localización del sonido [31], permitiendo, a su vez, mejorar la comprensión de la palabra hablada [32]. Otro beneficio de la bilateralidad radica en la completa estimulación de las vías y centros del sistema auditivo, promoviendo el desarrollo bilateral del córtex auditivo, cuestión no alcanzable en el caso de una estimulación unilateral con un único IC [33].
En nuestro estudio comprobamos una ganancia auditiva estadísticamente significativa tanto con la implantación unilateral como con la bilateral. Sin embargo, nuestros resultados muestran que dicha ganancia es menor con los IC bilaterales, siendo esta diferencia estadísticamente significativa.
Respecto a la duda de realizar el implante de forma secuencial o simultáneo, existen estudios que muestran que es mejor la modalidad simultánea o, de no ser posible, que el tiempo trascurrido entre ambos IC sea el mínimo posible (Manrique et al., 2004) [28], ya que se ha comprobado que existe una edad crítica a partir de la cual el segundo IC deja de ser efectivo [34]. La razón de esta actitud está basada en alcanzar un normal desarrollo de la actividad cortical auditiva [28, 33, 35].
Muchos de los resultados que se obtienen del estudio del lenguaje en niños con IC destacan por la gran variabilidad interindividual, proponiéndose algunos factores (ya mencionados en la introducción) que pueden afectar al beneficio obtenido con el implante. La relación de todas estas variables es difícil de cuantificar, pero tenerlas en cuenta puede ser de especial interés cuando se evalúa y trabaja con niños con IC que no muestran una mejora significativa [9].
Otro aspecto a tener en cuenta es la edad de implante. Si bien, a nivel audiométrico no se han visto grandes diferencias entre los estratos etarios (como también se comprueba en nuestro estudio), la mayor prematuridad de la intervención se ha relacionado muy estrechamente con un mayor desarrollo neurológico [18, 36] y, con ello, lingüístico y verbal. De esta manera se ha demostrado que una implantación antes del año o, al menos, no más tarde de los dos años de edad cronológica, está asociada a una mayor capacidad de percepción, comprensión y producción del lenguaje y a una mejor habilidad de lectura. Todo esto, para ser lo más efectivo y eficiente posible, ha de estar acompañado de una rehabilitación auditivo-verbal los más intensa y continua posible [36, 37].
En lo referente a nuestro estudio, los test de identificación de bisílabas de Cárdenas-Marrero y el Test de Percepción Temprana de la Palabra (ESP), nos permitió ver que la mayoría de ellos alcanza un alto nivel de identificación de bisílabas, en el caso del primer test, y una identificación consistente de la palabra (categoría 4 de 4), en el caso del segundo. Un análisis comparativo de estos resultados con la edad de implante y el tipo de este, no mostró diferencias estadísticamente significativas, lo cual podría deberse a la escasa muestra de niños que evoluciona negativamente.
El estudio de la evolución lingüística, a través del test Peabody, mostró que los niños implantados antes de los 18 meses evolucionaban mejor que aquellos que lo hacían después de los 36 meses, si bien el estrato intermedio no demostró diferencias en comparación con estos dos extremos. Estos datos concuerdan con algunos estudios que aseguran que existe un periodo crítico de unos dos años en los que es importante la implantación temprana, mientras que más allá de los 4 años los efectos de la deprivación auditiva son irreversibles, existiendo un periodo intermedio en el cual no se demuestra una variación interna significativa [36, 38]. En este sentido, Niparko y cols. [39] demostraron la asociación positiva entre la implantación temprana y un mejor desarrollo verbal, asegurando que cada año que se recorta al periodo de deprivación auditiva supone un mayor desarrollo verbal.
Analizando este test en relación al tipo de IC, se comprobó una distribución favorable hacia los IC bilaterales simultáneos, no existiendo una diferencia estadísticamente significativa entre los tres tipos de IC. Esto puede deberse a la pequeña muestra que suponían aquellos a los que se les realizó dicho test.
El implante coclear obtiene unos resultados auditivos mejores que la estimulación audioprotésica, además de mejorar significativamente el pronóstico de la deficiencia auditiva severa-profunda, demostrando ser un tratamiento efectivo contra dicha deficiencia y sus comorbilidades. La edad es fundamental en el desarrollo verbal (relación inversamente proporcional), no así en la ganancia auditiva. El análisis del desarrollo verbal basado en el tipo de implante mostró una distribución favorable a los IC bilaterales simultáneos, pero sin una diferencia estadísticamente significativa.
Este estudio fue presentado como Trabajo de Fin de Grado en la Facultad de Medicina de la Universidad de Salamanca en mayo de 2018, siendo los tutores del mismo el Dr. Enrique González Sánchez y el Prof. Fernando Benito González, de la Unidad de Implante Coclear Pediátrico del Servicio de Otorrinolaringología del Complejo Asistencial Universitario de Salamanca, en colaboración con José Manuel Gorospe Arocena de la Unidad de Foniatría, Logopedia y Audiología infantil de dicho servicio.
1. Manrique M, Morera C, Moro M. Detección precoz de la hipoacusia infantil en recién nacidos de alto riesgo. Estudio multicéntrico. An Esp Padiatr. 1994; 40(59):11-45.
2. Programa de detección precoz de hipoacusia neonatal. Dirección General de Salud Pública, Drogodependencias y Consumo. Consejería de Sanidad y Asuntos Sociales. Gobierno de Castilla-La Mancha; 2013.
3. Trinidad Ramos G, Jáudenes Casaubón C. Sordera infantil. Del diagnóstico a la inclusión educativa. Madrid: Confederación Española de Familias de Personas Sordas; 2012.
4. Year 2007 Position Statement: Principles and Guidelines for Early Hearing Detection and Intervention Programs. PEDIATRICS. 2007;120(4):898-921.
5. Núñez-Batalla F, Trinidad-Ramos G, Sequí-Canet J, Alzina De Aguilar V, Jáudenes-Casaubón C. Indicadores de riesgo de hipoacusia neurosensorial infantil. Acta Otorrinolaringológica Española. 2012;63(5):382-90.
6. Marco J, Mateu Sanchís S. Libro blanco sobre hipoacusia. Madrid: Ministerio de Sanidad y Consumo, Secretaría General Técnica; 2003.
7. Yoshinaga-Itano C, Sedey AL, Coulter DK, Mehl AL. Language of earlyand later-identified children with hearing loss. Pediatrics. 1998;102:1161–71.
8. Robinshaw HM. The pattern of development from non-communicative behavior to language by hearing-impaired infants. Br J Audiol. 1996;30:177–98.
9. Moruno López E. Desarrollo del lenguaje en niños con implante coclear: diseño de un corpus y su aplicación al estudio de la fonología. Departamento de Filología Española, Italiana, Románica, Teoría de la Literatura y Literatura Comparada. Facultad de Filosofía y Letras. Universidad de Málaga; 2016.
10. Ponton CW, Don M, Eggermont JJ, Waring MD, Kwong B, Masuda A. Auditory system plasticity in children after long periods of complete deafness. NeuroReport. 1996;8(1):61-5.
11. Gordon KA, Papsin BC, Harrison RV. Activity-dependent developmental asticity of the auditory brainstem in children who use cochlear implants. Ear Hear. 2003;24(6):485-500.
12. Gordon KA, Papsin BC, Harrison RV. Effects of cochlear implant use on the electrically evoked latency response in children. Hearing Researdh. 2005;204(1-2):78-89.
13. Papsin B, Gysin C, Picton N, Nedgelski J, Harrison R. Speech perception measures in prelinguistic deaf children up to 4 years after cochlear implantation. Ann Otol Rhinol Laryngol Suppl. 2000;185:38-42.
14. Kirk KI, Miyamoto RT, Ying E, Lento C, O’Neill T, Fears F. Effects of age at implantation in young children. Ann Otol Rhinol Laryngol Suppl. 2002;189:69-73.
15. Davis A, Wood S. The epidemiology of childhood hearing impairment: factors relevant to planning of services. Br J Audiol. 1992;26:77–90.
16. Programa de detección precoz y atención integral de la hipoacusia infantil en Castilla y León. [Valladolid]: Consejería de Sanidad. junta de Castilla y León; 2004.
17. Hickok G, Poeppel D. Dorsal and ventral streams: a framework for understanding aspects of the functional anatomy of language. Cognition. 2004;92:67-99.
18. Friederici AD, Alter K. Lateralization of auditory language functions: a dynamic dual pathway model. Brain and language. 2004;89(2):267-76.
19. 14. Dhondt C, Swinnen F, Dhooge I. Bilateral cochlear implantation or bimodal listening in the paediatric population: Retrospective analysis of decisive criteria. Int J Pediatr Otorhinolaryngol. 2018;104:170-7.
20. Seeber BU, Baumann U, Fastl H. Localization ability with bimodal hearing aids and bilateral cochlear implants. J Acoust Soc Am. 2004;116:1698-709.
21. Morera C, Manrique M, Ramos A, García-Ibáñez L, Cavalle L, Huarte A et al. Advantages of binaural hearing provided through bimodal stimulation via a cochlear implant and a conventional hearing aid: A 6-month comparative study. Acta Otolaryngol Suppl. 2005;125:596-606.
22. Miyamoto R, Kirk K, Todd S, Robins A, Osberger M. Speech perception skills of children with multichannel cochlear implant or hearing aid. Ann Otol Rhinol Laryngol. 1995;104(166):334-7.
23. Manrique M, Huarte A, Cervera F, Espinosa J, Molina M, Garcia Tapia R. Indications and counter indications for cochlear implantation in children. Am J Otol. 1998;19:332-6.
24. Luntz M, Brodsky A, Hafner H, Shpak T, Feiglin H, Pratt H. Sound localization in patients with cochlear implant-preliminary results. Int J Pediatr Otorhinolaryngol. 2002;64(1):1-7.
25. Real Patronato de Prevención y Atención a Personas con Minusvalía, Comisión de Expertos. Implantes Cocleares. Acta Otorrinol Esp. 2002;53:305-16.
26. Seeber BU, Baumann U, Fastl H. Localization ability with bimodal hearing aids and bilateral cochlear implants. J Acoust Soc Am. 2004;116:1698-1709.
27. Beijen J, Mylanus E, Leeuw A, Snik A. Should a Hearing Aid in the Contralateral Ear Be Recommended for Children with a Unilateral Cochlear Implant?. Ann Otol Rhinol Laryngol. 2008;117(6):397-403.
28. Tange R, Grolman W, Dreschler W. What to do with the other ear after cochlear implantation. Cochlear Implants International. 2009;10(1):19-24.
29. Van Hoesel RJM, Tyler RS. Speech perception, localization and lateralization with bilateral cochlear implants. J Acoust Soc Am. 2003;113(3):1617-30.
30. Mok M, Gakvin KL, Dowell RC. Spatial unmasking and binaural advantage for children with normal hearing, a cochlear implant and a hearing aid, and bilateral implants. Audiol NeuroOtol. 2007;12(5):295-306.
31. Litovsky RY et al. Bilateral cochlear implants in children: localization acuity measured with minimum audible angle. Ear Hear. 2006;27(1):
43-59.
32. Brown KD, Balkany TJ. Benefits of bilateral cochlear implantation: a review. Curr Opin Otolaryngol Head Neck Surg. 2007;15:315-8.
33. Gordon KA, Wong DD, Papsin BC. Cortical function in children receiving bilateral cochlear implants simultaneously or after a period of interimplant delay. Otol NeuroOtol. 2010;31:1293-99.
34. Graham J, Vickers D, Eyles J, Brinton J, Al Malky G, Aleksy W et al. Bilateral sequential cochlear implantation in the congenitally deaf child: evidence to support the concept of a ‘critical age’ after which the second ear is less likely to provide an adequate level of speech perception on its own. Cochlear Implants Int. 2009;10(3):119-41.
35. Hickok G, Poeppel D. The cortical organization of speech processing. Nature Reviews Neuroscience. 2007;8:393-402.
36. Geers A. Speech, Language, and Reading Skills After Early Cochlear Implantation. Arch Otolaryngol Head Neck Surg. 2004;130(5):634.
37. Fink N, Wang N, Visaya J, Niparko J, Quittner A, Eisenberg L et al. Childhood Development after Cochlear Implantation (CDaCI) study: Design and baseline characteristics. Cochlear Implants Int. 2007;8(2):92-112.
38. Holt R, Svirsky M. An Exploratory Look at Pediatric Cochlear Implantation: Is Earliest Always Best?. Ear and Hearing. 2008;29(4):492-511.
39. Niparko J, Emily T, Donna T, Laurie E. Spoken Language Development in Children Following Cochlear Implantation. JAMA. 2010;303(15):1498.