eISSN 2444-7986
DOI: https://doi.org/10.14201/orl.32020
ARTÍCULO ORIGINAL
PRONÓSTICO AUDIO-VESTIBULAR DE LOS PACIENTES CON SORDERA SÚBITA IDIOPÁTICA Y VÉRTIGO
Audio-vestibular prognosis of patients with idiopathic sudden hearing loss and vértigo
José Ignacio BENITO-OREJAS 1; María ÁLVAREZ-ÁLVAREZ
1; María ÁLVAREZ-ÁLVAREZ 2; José ALONSO-VIELBA
2; José ALONSO-VIELBA 3; María Fe MUÑOZ-MORENO
3; María Fe MUÑOZ-MORENO 4
4
1SACYL. Especialista ORL, emérito. Valladolid. España.
2SACYL. Hospital Clínico Universitario. Servicio de Otorrinolaringología y CCC. Valladolid. España.
3Especialista ORL. Valladolid. España.
4SACYL. Hospital Clínico Universitario. Servicio de Bioestadística de la Unidad de Apoyo a la Investigación. Valladolid. España.
Correspondencia: jbenitoorejas@gmail.com
Fecha de recepción: 19 de marzo de 2024
Fecha de aceptación: 7 de mayo de 2024
Fecha de publicación: 16 de mayo de 2024
Fecha de publicación del fascículo: 30 de septiembre de 2024
Conflicto de intereses: Los autores declaran no tener conflictos de intereses
Imágenes: Los autores declaran haber obtenido las imágenes con el permiso de los pacientes
Política de derechos y autoarchivo: se permite el autoarchivo de la versión post-print (SHERPA/RoMEO)
Licencia CC BY-NC-ND. Licencia Creative Commons Atribución-NoComercial-SinDerivar 4.0 Internacional
Universidad de Salamanca. Su comercialización está sujeta al permiso del editor
RESUMEN: Introducción y objetivos: Evaluar la relación entre la clínica y la función cócleo-vestibular en los pacientes diagnosticados de sordera súbita idiopática (SSI) asociada a vértigo (SV). Con este estudio pretendemos investigar la prevalencia de las lesiones vestíbulo-cocleares encontradas en los pacientes con SSI+V y la correlación del resultado de las pruebas de función vestibular con la severidad y el pronóstico de la hipoacusia. Material y método: Estudio retrospectivo/prospectivo de 42 pacientes diagnosticados de SSI+SV mediante audiometría, videonistagmografía, potenciales evocados miogénicos vestibulares cervicales y vHIT. Tuvimos en cuenta datos epidemiológicos y clínicos, complementándolos con un examen de resonancia magnética y un amplio estudio analítico. Finalmente evaluamos estadísticamente los datos obtenidos. Resultados: El deterioro cócleo vestibular varía en función del tiempo transcurrido desde el evento. Hay una estrecha correlación entre el grado de hipoacusia y la disfunción vestibular. El daño vestibular es mayor en caso de SSI profunda. Los receptores vestibulares más afectados fueron el sáculo y el conducto semicircular posterior y el menos afectado fue el anterior. La función del conducto semicircular horizontal es fundamental en la predicción de la hipoacusia. Discusión: El pronóstico de una paciente con SSI+SV, es un desafío que se va superando a medida que reconocemos los factores que determinan su evolución. Conclusiones: En el síndrome de SSI+SV, la severidad de la hipoacusia depende de la extensión del daño vestibular, pero también está influido por otros factores acompañantes.
PALABRAS CLAVE: Sordera súbita idiopática; vértigo; pruebas de función vestibular; audiometría; pronóstico; isquemia.
SUMMARY: Introduction and objectives: To evaluate in sudden sensorineural hearing loss (SSHL) patients with vertigo (V) the vestibular function and identify the clinical characteristics. The present study aimed to investigate the prevalence of vestibulocochlear lesions in SSHL+V and the correlation between vestibular function test results and SSHL disease severity and prognosis. Material and methods: 42 patients diagnosed with SSHL+V were investigated retrospective and prospectively. The patients underwent pure tone audiometry and vestibular function tests consisting of video-nystagmography, video head impulse test and cervical vestibular evoked myogenic potentials. We took into account epidemiological and clinical data, complementing them with a magnetic resonance imaging examination and an extensive analytical study. Finally, we statistically evaluated the data obtained. Results: Vestibular cochlear damage varies according to the time elapsed since the event. There is a close relationship between the degree of hearing loss and the degree of vestibular dysfunction. The alteration of all vestibular receptors studied and acute vertigo are more frequent in case of profound hearing loss. The most frequently damaged vestibular receptors were the saccule and the posterior semicircular canal and the least affected was the anterior semicircular canal. The function of the horizontal semicircular canal is critical in the prognosis of hearing loss. Discussion: Predicting the prognosis of a patient with SSHL+V is a challenge that is being overcome as we recognize the factors that determine its evolution. Conclusions: In SSHL+V syndrome, the severity of hearing loss correlates with the extent of vestibular damage, but the final prognosis depends on other accompanying factors.
KEYWORDS: Sudden sensorineural hearing loss; vertigo; vestibular function tests; hearing audiogram; prognosis; ischemia.
INTRODUCCIÓN
Desde 1944, la sordera súbita idiopática (SSI) se define como una pérdida auditiva neurosensorial (HNS) igual o superior a 30 dB HL, en 3 o más frecuencias consecutivas, con un tiempo de instauración inferior a 72 horas, de causa desconocida [1]. Ante la imposibilidad de registrar los casos resueltos espontáneamente, sin control médico, resulta difícil conocer su incidencia, aunque se estima entre 2 y 30/100.000 habitantes/año [1, 2]. La etiopatogenia de la SSI es muy variada; siendo las tres propuestas etiológicas principales, la infección vírica, la isquemia o hemorragia laberíntica y la alteración autoinmune [3]. La activación patológica de la vía de estrés celular es una hipótesis añadida [4], junto a otros factores relacionados con la ruptura de las membranas cocleares, la disfunción endotelial o la acción inflamatoria de las citoquinas [5].
Aproximadamente un 20-60% de pacientes con SSI presentan síntomas vestibulares (SV) antes, durante o incluso días después de la SSI [1, 6-8]. La SSI+SV asocia con más frecuencia hipoacusia de grado profundo [9-11] y se considera de peor pronóstico para la recuperación auditiva [12-13]. Pero el vértigo no es una enfermedad, sino un síntoma, que puede manifestarse como un síndrome vestibular agudo (similar al de la neuritis vestibular -NV-) [14], con una sintomatología más leve (mareo o inestabilidad), en forma episódica (vértigo posicional paroxístico benigno -VPPB-) e incluso, según la literatura, en un 30% de casos de SSI la exploración detecta alteraciones de los receptores vestibulares, sin clínica aparente. Cada una de estas manifestaciones engloba a un grupo heterogéneo de pacientes, donde los estudios histopatológicos no son concluyentes [15-17].
Es posible que el grado y el pronóstico de la SSI se encuentren funcionalmente relacionados con determinados patrones de daño vestibular [18], aunque no siempre es posible identificar una causa vascular o neural [19]. Teniendo en cuenta que la cóclea y el vestíbulo tienen una membrana estructural continua, rellena de un líquido común [20], el daño vestibular también puede ser secundario a cambios bioquímicos de ese fluido o al efecto de los productos de desecho generados tras la destrucción coclear [15-16].
Para explorar los procesos fisiopatológicos que subyacen en los pacientes con SSI+SV, se han aplicado diferentes pruebas clínicas: tradicionalmente la prueba calórica registrada con videonistagmografía (VNG) y más recientemente, los potenciales evocados miogénicos vestibulares (VEMPs cervicales y/u oculares) y la prueba de impulso cefálico (vHIT) [12, 19, 21-23]. En el 39-74% de casos de SSI+SV, se ha encontrado alterada la prueba térmica [24-25] y en un 40% los VEMPs [26]. La afectación vestibular descrita como más frecuente es la del CSP [27-28], seguida por el CSH [27]. Rambold et al., (2005) [29] identifican un subgrupo de pacientes con daño coclear y del CSP, donde se sugiere una etiología vascular en lugar de inflamatoria. El sáculo y el nervio vestibular inferior evaluados mediante cVEMP, se afectan con más frecuencia que en la NV. Pero aún estamos lejos de reconocer todos los patrones de lesión vestíbulo-coclear y de discernir la relevancia clínica del vértigo y el pronóstico de la SSI, en función de la localización del daño [30]. Por tales motivos, el objetivo de este trabajo ha consistido en estudiar la relación entre las características epidemiológicas y clínicas de los pacientes diagnosticados de SSI+SV, con las de su hipoacusia y las alteraciones vestibulares detectadas mediante pruebas funcionales, a fin de identificar factores de riesgo de tipo pronóstico.
MATERIAL Y MÉTODO
Participantes:
Los pacientes evaluados han sido diagnosticados en el Servicio de Otorrinolaringología de un Hospital Universitario de tercer nivel perteneciente al Sistema Nacional de Salud y este trabajo ha sido aprobado por el Comité Ético de Investigación (PI 22-2885).
Se trata de un estudio observacional retrospectivo/prospectivo basado en la historia clínica, en el seguimiento y en las exploraciones realizadas a la población seleccionada.
Criterios de inclusión: individuos de cualquier edad, que cumplan con la definición de SSI [1], asocien vértigo/mareo y realicen el seguimiento adecuado.
Los casos incluidos proceden fundamentalmente de la base de datos de SSI de nuestro Servicio ORL [13], de la utilizada para el registro de la oculografía y prueba calórica (ENG/VNG) y, de forma prospectiva, de los pacientes diagnosticados de SSI+SV entre 2019 y 2022.
Criterios de exclusión: aquellos casos con datos incompletos en la historia clínica, falta de exploraciones vestibulares, fallecimiento, rechazo de pruebas, diagnóstico específico (enfermedad de Ménière, neurinoma, zóster…) y otras patologías añadidas (de oído medio, vértigo o hipoacusia previa del oído afectado, patología tumoral o neurológica, etc.).
Variables analizadas: tuvimos en cuenta los datos demográficos y antecedentes personales, registrando también las siguientes variables: lado afecto, grado, conFiguración y evolución de la hipoacusia, presencia de hipoacusia contralateral, así como la manifestación clínica y duración del SV (Tabla 1, Anexo 1). La exploración física en caso de presentar síntomas vestibulares incluía la observación del nistagmo (NG), la evaluación de las posibles desviaciones segmentarias [31], y la realización de pruebas de función vestibular (VNG, vHIT de los 6 conductos semicirculares (CS) y cVEMPs), junto a una resonancia magnética (RM) y un estudio analítico (con bioquímica sanguínea, pruebas inmunológicas y serológicas).
Finalmente, a fin de obtener una valoración de la evolución temporal del daño audio-vestibular, hemos dividido a los pacientes en dos grupos según se hubiera realizado la exploración, antes o después de los 6 primeros meses de ocurrido el suceso.
Los datos se introdujeron en una base diseñada exprofeso en Microsoft Access, respetando la normativa de confidencialidad.
Pruebas diagnósticas:
Llevadas a cabo por personal entrenado:
- Audiometría (audiómetro clínico Audiotest 330® de Interacoustics, Dinamarca): Tras la exploración endoscópica (otomicroscopia), impedanciometría y acumetría, que descartan una hipoacusia de transmisión, se registra la audiometría tonal en el momento del diagnóstico y durante el seguimiento, a fin de valorar su evolución: /estable/, /mejoría/ o /empeoramiento/ [13] (Tabla 1, Anexo 1). Partiendo del registro de SSI en el periodo comprendido entre 2000 y 2019, seleccionamos a los pacientes a quienes se detectó SV añadido [13]. De ellos obtuvimos los valores de PTA (pure tone average: promedio de la pérdida en “dB” de las frecuencias 0,25 a 8 kHz) inicial y después de 3 meses de tratamiento y el grado de recuperación global. En función del PTA, clasificamos la severidad de la pérdida auditiva en leve (21 a 40 dB), moderada (41-70 dB), severa (71-90 dB) y profunda (>90 dB). Según la conFiguración del audiograma, lo catalogábamos en 3 tipos: perfil descendente hacia tonos agudos, hacia tonos graves/medios y audiograma plano, con afectación pantonal.
- La electronistagmografía (ENG: equipo Nicolet NystarTM Plus®, Madison, Wisconsin) aplicada hasta 2011 o la videonistagmografía (VNG: VN415/VO425®, Interacoustics, Dinamarca), a partir de entonces; consisten en el registro y análisis de los movimientos oculares en respuesta a estímulos visuales y vestibulares. Tras el consentimiento informado, se le indica expresamente al paciente que acuda a la prueba acompañado y sin maquillaje, absteniéndose, si es posible, de toda medicación sedante 72 horas antes. Tras el ajuste apropiado de los electrodos en la ENG o de las gafas de VNG (dotadas de 2 cámaras laterales de infrarrojos), con el paciente sentado y en oscuridad, se realiza una calibración ocular. A continuación, aplicamos por el siguiente orden las pruebas visoculares: estudio del NG espontáneo y de la mirada, seguimiento lento y rápido, sacadas fijas y aleatorias, y estimulación optocinética lenta y rápida. Tras cada exploración el equipo ofrece automáticamente el valor de los parámetros analizados, que nos permite conocer su normalidad y asimetría.
- La prueba calórica (bitérmica) sirve para evaluar la función del CSH. Se realizó con ENG/VNG utilizando un irrigador de agua en circuito abierto (modelo NCI-480® de ICS medical), siguiendo la metodología clásica [32]. Tras otoscopia y limpieza del canal, disponíamos al paciente en decúbito supino con la cabeza elevada unos 20-30 grados, en una habitación semioscura. En caso de ENG se colocan unas gafas de Frenzel, indicando permanecer con los ojos abiertos y si es una VNG disponemos las gafas correspondientes, eliminando la fijación. Durante la prueba, procuramos mantener el estado de alerta del paciente, conversando o realizándole preguntas sencillas. Irrigábamos un volumen de 250 ml, en 30 segundos, a 44ºC y 30ºC, comenzando por la estimulación caliente en oído derecho, seguido del izquierdo, y manteniendo el mismo orden con el agua fría. En el periodo de declinación de la respuesta, realizábamos una prueba de fijación. Esperábamos 7 minutos entre irrigaciones sucesivas. Tras revisar el registro de posibles artefactos, se obtiene el valor de la velocidad máxima de la fase lenta del NG, promediada en los 30s de máxima respuesta; y aplicando la fórmula de Jongkees et al., (1964) [33], considerábamos patológico un índice de hipofunción superior al 22/25% y de preponderancia mayor del 28/30% (según se tratara de ENG/VNG); con una suma total de las 2 irrigaciones de cada oído, no inferior a 12º/s (paresia), ni superior a 140º/s (hiperreflexia). Cuando no había respuesta, aplicábamos una irrigación con agua helada (4ºC), 10cc en 20-30 segundos, para comprobar una posible arreflexia del CSH.
- Prueba de impulsos cefálicos video-asistida o video head impulse test (vHIT), mediante un equipo vHIT ICS Impulse® de Otometrics (Copenhague). El paciente se sienta en una habitación parcialmente iluminada, procurando eliminar reflejos. Tras explicarle la prueba y con la cara sin maquillaje, se le colocan las gafas del equipo, con la cámara a la derecha, lo más ajustadas posible. Se le instruye para que fije su mirada en una diana, dispuesta a la altura de los ojos y a un metro de distancia. Efectuamos la calibración del sistema y comenzamos estudiando los canales horizontales. Indicamos al paciente que fije su mirada en la diana y mantenga los ojos bien abiertos, evitando el parpadeo, y situados por detrás, sujetamos con ambas manos la cabeza eludiendo el contacto con las gafas o su correa e imprimimos movimientos rápidos (100º a 250º/s) y cortos (10-20º), aleatorios e impredecibles, de derecha a izquierda, hasta alcanzar, si es posible, 20 impulsos aceptados en cada dirección. En algún caso complementábamos esta exploración, aplicando el paradigma de supresión del impulso cefálico (SHIMP). Estudiamos posteriormente los canales verticales, colocando la cabeza del paciente en posición “LARP” (left anterior, right posterior) y a continuación “RALP” (right anterior, left posterior) y aplicando una metodología similar, imprimimos movimientos cortos y rápidos, con una mano en la barbilla y otra en la parte alta de la cabeza, hacia abajo (estimulando el canal anterior correspondiente) y hacia atrás (el canal posterior). Terminada la prueba, el equipo aplica un conjunto de algoritmos que nos permiten conocer la ganancia del RVO, su asimetría y la medida de las sacadas correctoras de refijación covert y overt.
- Potenciales evocados miogénicos vestibulares cervicales (cVEMPs), que principalmente miden la función sacular a través de la respuesta inhibitoria del músculo esternocleidomastoideo (ECM) ipsilateral y que registramos mediante el equipo Eclipse EP15® de Interacoustics (Dinamarca) y programa OtoAccessTM. Como en el resto de las exploraciones, se explican las características de la prueba a través del consentimiento informado. Tras la limpieza y abrasión de la piel se disponen los electrodos: tierra (en la frente), positivo (en esternón) y negativo en el 1/3 medio del ECM derecho e izquierdo (registro ipsilateral). Auriculares intraauriculares. Estando el paciente sentado, gira el cuello primero hacia la derecha (contracción de músculo ECM izquierdo) y mediante control visual de la barra de electromiografía en la pantalla del ordenador, situada a la derecha, se le pide que mantenga una contracción entre 50 y 100 uV. Con el nivel de contracción adecuado, enviamos estímulos al oído izquierdo (tone-burst de 500 Hz) a 100 dB hasta obtener una curva P1-N1 con buenos niveles de reproductibilidad; descendiendo posteriormente de 10 en 10 dB hasta umbral. Realizamos a continuación los mismos pasos en el oído derecho. Finalmente, emparejamos las ondas del mismo nivel de intensidad de ambos lados, para que el equipo calcule la asimetría, cuya amplitud consideramos patológica si supera el 40% de diferencia.
- Análisis estadístico: Las variables cuantitativas se presentan con la media y la desviación típica y las cualitativas según su distribución de frecuencias.
- Mediante el test Chi-cuadrado de Pearson, se ha analizado la asociación de las variables cualitativas. En el caso de que el número de celdas con valores esperados menores de 5 es mayor de un 20%, se ha utilizado el test exacto de Fisher o el test Razón de verosimilitud para variables con más de dos categorías.
- Se realizó un modelo de regresión logística multivariante para analizar las variables asociadas a la hipoacusia profunda y a la mejoría auditiva, sin obtener resultados concluyentes.
- Para la evaluación estadística, hemos utilizado un programa IBM SPSS Statistics versión 29.0 para Windows. Aquellos valores de p<0,05 han sido considerados estadísticamente significativos.
RESULTADOS
Demográficos:
En la Tabla 1 (Anexo 1) se presentan las características de los 42 pacientes seleccionados con SSI+SV en el periodo 2005-2022. De los 170 registrados con SSI, un 25% asociaban SV [13]. De ellos escogimos a 19 y añadimos 8, rescatados de la base de exploración oculográfica (EOG/VNG), donde por diferentes motivos, no habían sido incluidos en la de SSI. Entre 2019 y 2022 registramos prospectivamente a 15 pacientes más. Todos los diagnosticados de SSI fueron tratados con corticoides, siguiendo el protocolo establecido [13]. El 64% eran mujeres y la edad media global fue de 54,5 años (DS±19; Me=58,5; rango 4 a 80 años). En la Figura 1 se muestra la distribución de la población por décadas, destacando la de 61 a 70 años (31%). La afectación del lado derecho se produjo en un 60%. El grado de HNS fue leve (7%), moderado (19%), severo (24%) y profundo (50%) (Figura 2). La conFiguración del audiograma es plano en el 63%, pendiente hacia tonos agudos en el 32% y descenso en tonos medios y/o graves en el 5% de los pacientes.
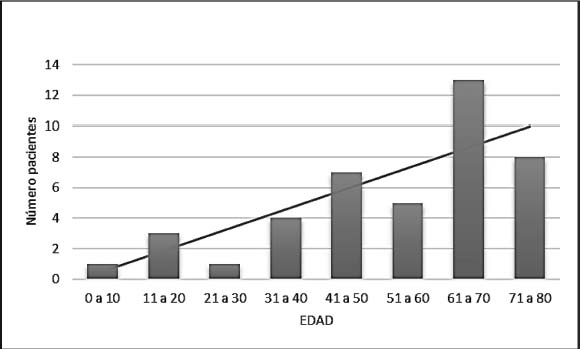
Figura 1. Número de pacientes en función de la edad, agrupados por décadas. N= 42. Edad media: 54,5±19 años. Mediana: 58,5. Rango: 4 a 80 años.
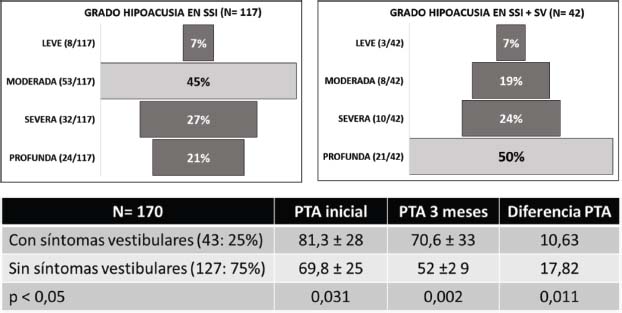
Figura 2. Si se asocia SV a la SSI, el grado de hipoacusia inicial es significativamente mayor (81,3 / 69,8) y la mejoría al cabo de 3 meses (diferencia PTA) significativamente menor (10,6 / 17,8). La recuperación completa es del 12% con SV y del 21% sin SV.
Partiendo de los resultados obtenidos en nuestra población de pacientes con SSI [13], en la Tabla incluida en la Figura 2, se muestra que en la SSI+SV el grado de hipoacusia inicial (PTA inicial) es “significativamente” mayor, y la mejoría al cabo de 3 meses (diferencia PTA) “significativamente” menor, que en la SSI sin aparente SV. La hipoacusia profunda es más frecuente en presencia de SV (50% vs 21%). Los casos de recuperación auditiva “completa” se duplican en la SSI sin SV (24% vs 12%) y la recuperación nula, es el doble si el paciente asocia SV (73% vs 34%) [13].
La hipoacusia profunda es mucho más frecuente en caso de SSI + SV (50% / 21%).
En las Tablas 2 a 4 (Anexos 2 a 4) analizamos la interrelación entre determinados factores de riesgo -FR- (vascular, edad, género), características de la SSI (grado de hipoacusia, lado afectado, configuración, evolución, presencia de hipoacusia contralateral) y del SV asociado (clínica vertiginosa, duración del vértigo, etc.); resaltando los siguientes aspectos.
Hipoacusia:
- Un 48% de pacientes con SSI+SV tienen algún FR vascular (HTA, dislipemia, tabaquismo, diabetes, cardiopatía, anticoagulación), lo que conlleva una edad media superior al resto (66 frente a 46 años; p<0,001), pero similar a la encontrada en la SSI [13]. La edad > 60 años (50%), vincula una alteración vestibular global “significativamente” más importante (p<0,001) (Tabla 2, Anexo 2).
- De los factores analizados (Tablas 2 a 5, Anexos 2 a 5), los que asocian una hipoacusia profunda en proporción “significativa” son: la presencia de alteración vestibular (p<0,001), la existencia de hipoacusia contralateral (p=0,03), el género masculino (p=0,004) y la RMN patológica (p=0,023); pero no es significativa la influencia de la edad o la presencia de FR vascular (Tablas 2 y 3, Anexos 2 y 3).
- Siendo la edad media similar entre sexos (Tabla 2, Anexo 2), en los hombres predomina la hipoacusia profunda (p=0,004) y una mayor alteración vestibular (p=0,0026) (Tabla 2, Anexo 2).
- La hipoacusia contralateral (24%) se asocia más frecuentemente con FR vascular (40% vs 9%; p=0,019) y con mayor porcentaje de hipoacusia profunda (80% vs 41%; p=0,030). (Tablas 2 y 3, Anexos 2 y 3).
- En todos los casos se hizo un seguimiento audiométrico, mejorando la audición en el 27%, empeorando en el 10% y no modificándose en el resto [13] (Tabla 1). Los principales factores que asocian una falta de mejoría auditiva son la presencia de hipoacusia profunda (p=0,001) y en menor proporción la alteración vestibular global (p=0,012) y un vHIT-CSH patológico (p=0,023) (Tablas 2 y 5, Anexos 2 y 5).
Vértigo:
- El síntoma vértigo fue registrado como brusco e intenso en un 73%, moderado/mareo en un 24% y posicional en un 3% (Tablas 1 y 4, Anexos 1 y 4). Reparamos en la presencia de VPPB en 6 pacientes, 4 del CSP y 2 del CSH (uno geo y otro ageotrópico). Registramos el NG espontáneo en 23 pacientes (en dos, batía hacia el lado parético -irritativo-, cambiando posteriormente su dirección hacia el lado sano).
- La clínica vertiginosa aguda no tiene relación significativa con la hipoacusia profunda y no implica una mayor alteración vestibular (Tabla 4, Anexo 4). La duración del vértigo (horas o días) no parece influir en el pronóstico.
- Los FR que en proporción significativa asocian lesión vestibular son: la SSI profunda (p<0,001), la edad > 60 años (p<0,001), la presencia de hipoacusia contralateral (p<0,001) y la RMN patológica (p<0,001), siendo también superior en el género masculino (p=0,0026) (Tablas 2 y 3, Anexos 2 y 3).
- En la hipoacusia contralateral, la alteración vestibular detectada, casi duplica (68%) a quienes oyen bien del oído contrario (35%) (p<0,001) (Tabla 3, Anexo 3).
- La RM fue “patológica” en el 33% (13/39 pacientes) (Tabla 2, Anexo 2), cuatro con signos de hemorragia intralaberíntica; tres con alteración de señal en el laberinto, sospechoso de laberintitis; cuatro con leucoencefalopatía y enfermedad de pequeño vaso; y dos con infartos en protuberancia y pedúnculo cerebeloso.
- En los cuatro casos (4/42: 9,5%) de hemorragia intralaberíntica (de 47 a 70 años), hubo cofosis y disminución de la amplitud del cVEMP (afectación del sáculo). En tres, alteración conjunta de CSH y CSV. Tres presentaban FR vascular, pero hubo un paciente, de 70 años, con FR vascular y menor amplitud en cVEMP, en el que tan solo se afectó el CSH, cuya ganancia se normalizó posteriormente.
- La RMN patológica se relacionaba significativamente con la edad (> 60 años, p=0,013), la presencia de hipoacusia profunda (p=0,023) y la alteración vestibular global (p<0,001).
Exploración:
Para catalogar el pronóstico, es importante conocer el momento en el que se realiza el estudio audio-vestibular. A 33 pacientes les efectuamos las exploraciones funcionales vestibulares después de 6 meses del suceso de SSI+SV y a 9 en los primeros 6 meses.
No utilizamos en todos los casos las mismas pruebas vestibulares. En la Tabla 1 (Anexo 1) se muestra el porcentaje de aplicación de cada una de las manejadas. Al 76% (32/42) se le hicieron todas las exploraciones siguientes: auditivas, vHIT del CSH, vHIT-CSP, vHIT-CSA y cVEMP. En la Figura 3 se representa el porcentaje de anomalías de cada examen y el de la disfunción del receptor cócleo-vestibular correspondiente: cóclea (100%), sáculo/cVEMP (52%), CSP (50%), CSH (vHIT y VNG) (42%), CSA (19%). En la misma Figura, también se detallan diferentes patrones de daño. En el 25% no se detectaron alteraciones vestibulares y en el 19% la afectación era global (cóclea, 3 conductos semicirculares -CS- y sáculo) (Tablas 1 y 4, Anexos 1 y 4). Comparando resultados, se observa que la alteración vestibular disminuye de forma significativa después de los 6 meses (p<0,001) y aunque el porcentaje de hipoacusia profunda crece después de 6 meses (44% vs 52%), no lo hace de forma significativa (Tabla 4, Anexo 4).
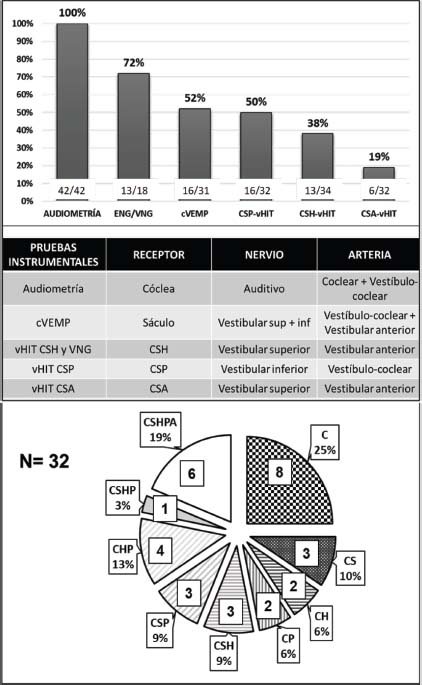
Figura 3. El gráfico de barras superior, expresa el porcentaje de anomalías audio-vestibulares detectadas, con las pruebas aplicadas, en los pacientes diagnosticados de SSI + SV. En la Tabla se muestra la relación entre las pruebas funcionales utilizadas, los receptores que analizan y su correspondiente inervación y vascularización (modificado de Pogson et al., (2016) [14]). Finalmente, el gráfico de tarta inferior (modificado de Fujimoto et al., (2015) [12]), ilustra la distribución de las anomalías detectadas en 32 pacientes a los que estudiamos con audiometría, cVEMP, vHIT de CSH y vertical. (C: cóclea; S: sáculo; H: CSH; P: CSP; A: CSA). 8 pacientes (25%) sólo tienen alteración coclear y en 24 se encuentra, además, una disfunción vestibular (75%).
En la Tabla 5 relacionamos las diferentes pruebas vestibulares realizadas (prueba térmica-VNG, vHIT de CSH, CSP, CSA y cVEMP), según fuera el resultado patológico o normal, con las distintas variables que hemos considerado (edad > o < de 60 años, género, FR vascular, lado, hipoacusia profunda, conFiguración hacia tonos agudos, mejoría auditiva, presencia de hipoacusia contralateral, vértigo agudo, RMN patológica y con el resto de pruebas vestibulares patológicas):
- De los pacientes a quienes realizamos prueba térmica (47%), el 67% manifestaba paresia o arreflexia unilateral y el 6% bilateral. La concordancia entre el resultado patológico de la prueba térmica (paresia/arreflexia) y del vHIT-CSH, sólo se produjo en el 50% de los casos, siendo el vHIT-CSH en el resto, normal. La prueba térmica patológica se relaciona significativamente con la hipoacusia profunda (p=0,009) y con la RMN patológica (p=0,009).
- Cuando comparamos mediante vHIT, la afectación del CSH (38%) con la de los CSV (afectados globalmente en el 50%), el 50% presenta alteración del CSH y de algún CSV, el 39% sólo de CSV y el 11% del CSH exclusivamente. La disfunción de los CSV, corresponde en el 27% de casos al CSA y en el 73% al CSP. En el 63% de los pacientes con disfunción del CSP, la respuesta del CSA del mismo lado, es normal.
- La alteración del vHIT de cualquier CS se relaciona significativamente con la hipoacusia profunda: vHIT CSH (p<0,001), CSA (p=0,008) y CSP (p=0,013).
- Tan solo un 19% de pacientes evaluados con vHIT mostró alteración del CSA, pero se asoció en todos los casos con disfunción del resto de los receptores vestibulares analizados (sáculo, CSH y CSP) y con hipoacusia profunda. El vHIT patológico del CSH (38%), le sigue en frecuencia de lesiones asociadas en el laberinto, presentando otras alteraciones vestibulares en un 76% de casos (p<0,001) e hipoacusia profunda en un 85% (p<0,001) (Tabla 5, Anexo 5).
- De 31 cVEMP realizados, la amplitud está disminuida en 16 (52%). La disminución de amplitud de los cVEMP, puede manifestarse aislada (25%), asociada a déficits del CSH y de CSV (44%), sólo del CSV (19%) o sólo del CSH (13%). El 75% de cVEMP patológicos vincula una alteración de los CS (12/16), mientras que, si el cVEMP es normal, la afectación de los CS es del 40% (9/15). Es decir, la disfunción del sáculo (amplitud de cVEMP disminuido), se asocia a un daño de CS significativamente mayor (p<0,001); pero no guarda relación significativa con la hipoacusia profunda (Tabla 5, Anexo 5).
DISCUSIÓN
La afectación vestibular en la SSI fue descrita inicialmente por Rasmusen en 1949 [34] y desde entonces se estudia la influencia del vértigo en las manifestaciones clínicas y el pronóstico de la SSI [24-25, 30].
La asociación de SSI+SV es una urgencia poco frecuente [14], y el porcentaje de casos identificados por nosotros en el grupo de pacientes analizados con SSI (del 25%) (Figura 2) corresponde al límite inferior del reflejado en la literatura (20-60%) [6-8, 14, 18, 21, 30]. Esta circunstancia quizá se deba a que a lo largo de los 17 años de seguimiento (2005-2022), algunos pacientes fueron desechados de nuestra población al ser diagnosticados de enfermedad de Menière u otras patologías específicas, y quizá también porque con frecuencia los síntomas de la hipoacusia son más llamativos que los vestibulares, pudiendo éstos pasar desapercibidos o manifestarse posteriormente en horas o días, no siendo diagnosticados [1, 6, 11-12, 18]. Nuestra población (n=42), es similar a la de otros estudios [7, 12, 14, 35-37]. Veintisiete de los 42 pacientes (64%) fueron revisados retrospectivamente y citados en consulta en 2021-22, para conocer su evolución clínica y reevaluar la exploración funcional audio-vestibular (que pudo llevarse a cabo en el 63%). 36% se estudiaron prospectivamente.
Con un discreto predominio en mujeres (60%) y en el oído derecho, la edad media (54,5 años) es similar a la de los pacientes con SSI.
Centraremos la discusión en dos apartados. En el primero comentaremos algunos aspectos de la etiopatogenia de este proceso, esencialmente desconocida; para posteriormente discutir sobre el pronóstico de la hipoacusia en la SSI+SV, en relación con la clínica y los receptores vestibulares afectados.
Etiopatogenia:
Aunque se han llevado a cabo estudios histopatológicos para explorar la patogénesis de la SSI+SV, los resultados han sido controvertidos [18]. De acuerdo con la anatomía del laberinto [38], ciertos patrones de isquemia vascular o de afectación neural podrían explicar los hallazgos de algunos pacientes (tal y como se expresa en la Tabla de la Figura 3). Pero Khetarpal publica en 1991, que la presencia de vértigo no se asocia con alteraciones estructurales de los mecanorreceptores o de los nervios vestibulares, sospechando que la causa del daño podría deberse a cambios en los fluidos del oído interno [15, 18]. La transformación de los líquidos laberínticos tras la destrucción coclear, con la liberación de macromoléculas y otros elementos, se describen como responsables del NG irritativo, detectado inicialmente en alguno de nuestros casos o de un VPPB persistente [7, 15-16, 27, 41]. La aparición de VPPB secundario a una SSI se refiere en un 8-19% [27-28, 39]. En nuestros resultados, aunque sólo un paciente manifestó inicialmente clínica posicional, lo detectamos poco después en seis (14%), cuatro del CSP y dos del CSH [27-28]. Quizá porque la causa no solo resida en el desprendimiento de otoconias, sino también, en la posible liberación de productos de desecho tras el daño coclear (aunque ninguno de nuestros casos se asoció con hemorragia laberíntica -tal y como explica la hipótesis de Kim et al., (2014)- [41]), la duración de los síntomas puede ser mayor y se requieren más maniobras de reposición que en los afectados de VPPB idiopático [21, 27, 39, 41]. Cuatro de estos seis pacientes, asocian disfunción del CSP o del CSH, que al no ser un hallazgo propio del VPPB idiopático, se supone que depende de los efectos de la SSI, más que del VPPB per se [21, 39]. La afectación del CSP o del CSH no guarda relación con que el VPPB sea posterior u horizontal [39]. Finalmente, es controvertido saber si la presencia de VPPB asocia peor pronóstico de recuperación auditiva [27-28, 39], pero así ocurrió en los seis pacientes referidos, dos de los cuales debutaron con una hipoacusia profunda y otros dos progresaron de severa a profunda, dando un porcentaje global de hipoacusia neurosensorial profunda superior al general (67% vs 50%, Tabla 3).
Se podría suponer que, en caso de edad avanzada con FR vascular, la isquemia, potenciada por los requerimientos energéticos y la circulación terminal del laberinto, favorecería el SV en la SSI, pero la edad media y la proporción de pacientes con FR vascular es similar al de la población general de SSI sin SV [13]. Es posible que, en los casos de cofosis y vértigo agudo, la hemorragia perilinfática, sea más frecuente de lo que se suele diagnosticar [2, 25 40-41]. En la literatura se expresa una incidencia de hemorragia laberíntica del 1,8% en caso de SSI+SV [42], que en nuestros resultados ha sido del 9,5% (4/42), quizá porque hemos estudiado con detenimiento cada RMN realizada, incrementándose el número de afectados tras una segunda revisión. Aunque también es posible que se perdieran otros, dado que la señal en RMN desaparece entre 2 semanas y 4 meses [42].
Rambold et al., (2005) [29] y Murofushi et al., (2019) [43] describen el “síndrome de la arteria cócleo-vestibular” en tres pacientes con hipoacusia en tonos agudos y disminución del RVO del CSP (con normalidad del CSH, CSA y cVEMP). Según la anatomía vascular del laberinto [38], la arteria cócleo-vestibular irriga la espira basal de la cóclea (responsable de la audición en tonos agudos), el sáculo y la ampolla del CSP. Como el sáculo también recibe irrigación de la arteria vestibular anterior, en caso de isquemia de la arteria cócleo vestibular, el sáculo podría mantener su integridad (afectándose la espira basal de la cóclea y el CSP). Sin embargo, si la SSI+SV fuera causada por una laberintitis vírica, según la hipótesis de Murofushi et al., (2019) [43] la expansión del virus desde la cóclea hasta el CSP, afectaría necesariamente al sáculo (hipoacusia y disfunción del CSP y sáculo) [43]. De los 16 pacientes que en nuestra casuística muestran disfunción del CSP, sólo cuatro tienen un audiograma con caída en tonos agudos, ninguno con afectación exclusiva del CSP y sólo tres, con alteración del CSP y del sáculo, donde tendríamos que sospechar, por tanto, una laberintitis vírica. Pero estamos de acuerdo con Pogson et al., (2016) [14], que las pruebas vestibulares no permiten en la actualidad, separar los procesos isquémicos del resto de causas.
Aunque no hemos encontrado ningún caso, algunos sugieren que los factores de riesgo ateroescleróticos y la obstrucción de la arteria cerebelosa antero-inferior, se asocian con SSI [44]. Por este motivo ante un paciente con SSI+SV, sobre todo con vértigo agudo, tendremos en cuenta la presencia de factores de riesgo vascular y aplicaremos el protocolo HINT, junto al resto de pruebas de función vestíbulo-coclear, exploración óculo-motora y RMN, para descartar una posible causa vascular central [14, 23].
Pronóstico de la SSI+SV:
Como expresábamos en los resultados (Tabla incluida en la Figura 2), en la SSI+SV el grado de hipoacusia inicial es “significativamente” mayor, y la mejoría auditiva “significativamente” menor, que en la SSI sin aparente SV. La hipoacusia profunda es más frecuente en presencia de SV (50% vs 21%). Por lo que de acuerdo con otros autores concluimos, que la severidad de la hipoacusia se correlaciona con el daño general del laberinto y a su vez, la disfunción vestibular total tiene una relación estadísticamente significativa (p<0,001) con la hipoacusia profunda (Tabla 3, Anexo 3) [9-14, 20, 22, 35-37]. Además, el 100% de los pacientes estudiados, con todas las pruebas vestibulares afectadas (n=6, Figura 3), presentaba hipoacusia profunda, mientras que, en los 8 casos con todas las pruebas vestibulares normales, la hipoacusia profunda sólo se produjo en el 25% (p=0.005) (Tabla 4, Anexo 4). Finalmente, junto a otros autores, también hemos encontrado una relación positiva entre el número de receptores vestibulares lesionados y la severidad de la hipoacusia [8].
La mutua influencia entre el vértigo y la sordera profunda, hace suponer que la evaluación de los patrones de disfunción vestibular involucrados en la SSI, podría predecir el pronóstico de la pérdida auditiva [25, 18]. Pero la literatura ofrece resultados contradictorios, donde algunos afirman que la paresia vestibular supone un valor pronóstico negativo [11-12, 24, 37], mientras otros consideran que la afectación vestibular “no” tiene valor predictivo [7,18, 30].
Al realizar la evaluación, tendremos en cuenta el tiempo transcurrido desde el suceso. Hao et al., (2023) [8], comprueban que la función vestibular mejora a los 2 meses del evento y nosotros corroboramos esta mejoría significativa después de 6 meses (p<0,001).
La disfunción de cualquier receptor vestibular puede producir vértigo [18], pero ¿cuáles se considera que tienen una influencia más negativa en la recuperación auditiva? Siguiendo la sistemática de Fujimoto et al., (2015) [12] aplicada también por Wang et al., (2020) [18], clasificamos a los pacientes en diferentes tipos, basándonos en la disfunción audio-vestibular encontrada (Figura 3). Según estos autores, entre un 70-75% de pacientes con SSI+SV presentan uno o más receptores vestibulares afectados [18-19] (nos 75%, Figura 3); por tanto, en un porcentaje aproximado del 25%, el síntoma vértigo no refleja, con los procedimientos actuales de exploración, la presencia de una patología del laberinto posterior (Figura 3) [7, 45] (Tabla 4, Anexo 4), que tal y como hemos visto, podría haberse recuperado en función del tiempo transcurrido hasta la exploración. Para Inagaki et al., (2012) [16] el sistema vestibular experimenta los mismos cambios en la SSI, haya o no vértigo; y por otra parte, como hemos dicho, los receptores vestibulares pueden alterarse, sin que el vértigo sea evidente [10, 30, 37, 45]. Teniendo en cuenta estas excepciones, lo habitual es que la presencia de vértigo exprese un mayor riesgo de lesión vestibular y por tanto sea un importante indicador pronóstico [30]. Si la hipoacusia es profunda, el vértigo suele manifestarse de forma brusca e intensa, con frecuencia precedido de la sintomatología auditiva (Tabla 3, Anexo 3).
De acuerdo con otros autores [18, 22], opinamos que el pronóstico final no sólo depende de la importancia del SV acompañante, sino también del grado de hipoacusia, de la edad del paciente, de los factores de riesgo vascular y de la etiopatogenia del proceso, entre otros. A través de un análisis multivarianza, Byun et al., (2020) [45], encuentran que la mala recuperación auditiva en la SSI se asocia a la edad, la paresia de la prueba térmica, la mayor pérdida auditiva inicial y un anómalo vHIT del CSP, coincidiendo con otros autores [19] en que la gravedad de la hipoacusia y la afectación del CSP, son los factores más importantes. En nuestros resultados, los FR que determinan un “significativo” peor pronóstico, son: la presencia de hipoacusia profunda (p<0,001), un mayor grado de alteración vestibular total (p=0,012) y un vHIT-CSH patológico (p=0,023) (Tabla 3, Anexo 3). Es decir, estando de acuerdo en que la recuperación auditiva depende del grado de pérdida inicial y de la afectación vestibular, la disfunción del CSH implica en nuestros casos y en los de otros, peor pronóstico que la del CSP (Tabla 5, Anexo 5) [11, 22].
Y ¿qué receptores se lesionan con más frecuencia? Nuestros resultados están de acuerdo con quienes encuentran que en los pacientes con SSI+SV, el sáculo se afecta más frecuentemente que el CSH [8, 46] (Figura 3 y Tabla 5). Fujimoto et al., (2015) [18] e Iwasaki et al., (2005) [46], establecieron que las anomalías vestibulares se van produciendo progresivamente desde la cóclea, empezando por el utrículo (oVEMP), el más cercano, seguido por el sáculo (cVEMP) para finalmente alterarse los CS. Quaranta et al., (2020) [5], también encuentran una disfunción precoz de las máculas frente a los CS; lo que coincide con los estudios histopatológicos, que describen cambios más tempranos en la mácula sacular [3, 16-17]; pero también se opina lo contrario, refiriéndose una mayor tasa de lesión en los CS [9, 23, 30].
Hay un acuerdo más generalizado en considerar que el CSP es el CS que se lesiona con mayor frecuencia, tal y como hemos comprobado en nuestros pacientes [20, 45] (Tabla 5, Anexo 5).
Maia et al., (2020) [26] realizan una revisión bibliográfica, seleccionando los trabajos donde a los pacientes con SSI+SV se les estudia con VEMP y observan que, en conjunto, están alterados en un 41,5% (nos cVEMP 52%, Tabla 5). En los pocos artículos que analizan la tasa de recuperación auditiva, la mayoría sugiere que la disfunción de los VEMP, es de mal pronóstico [9, 30]. En nuestros resultados esta diferencia no es significativa (Tabla 5, Anexo 5), sin embargo, la disminución de amplitud del cVEMP se relaciona con un mayor grado de afectación vestibular global (p<0,001) (Tabla 5, Anexo 5). Niu et al., (2016) [11], tampoco encuentran correlación entre la alteración del cVEMP y la pérdida de audición. También se discute si la conFiguración de la hipoacusia con caída hacia tonos agudos se vincula con una lesión de mácula sacular o de paresia de CSH [9], que en nuestros resultados es similar (62% asocia paresia CSH y 55% cVEMP patológico). Tampoco conocemos cuál de los dos órganos otolíticos (utrículo o sáculo) se afecta con más frecuencia, no disponiendo de datos suficientes para establecer qué prueba VEMP (ocular o cervical) sería más específica en la determinación del pronóstico [26].
En la literatura se establece que el 39-74% de pacientes con SSI+SV tienen paresia vestibular en una prueba calórica [7, 11, 30]. Nosotros la encontramos en el 72%, y en el 100% de los que debutan con hipoacusia profunda (Tabla 5, Anexo 5) [35]. En nuestros resultados hay un mayor porcentaje de afectación en la prueba térmica (72%) que en el vHIT del CSH (38%) (Tabla 5, Anexo 5), lo que en parte podría deberse a que el vHIT es normal hasta que la paresia vestibular en la prueba calórica supera un umbral [21, 47] y en parte, a que se haya producido en el tiempo mediado entre ambas exploraciones, una compensación vestibular, donde la respuesta a los rápidos movimientos de la cabeza se adapta antes, que al estímulo calórico no-fisiológico; teniendo en cuenta, no obstante, que ambas exploraciones analizan frecuencias muy diferentes [8, 21].
Limitaciones del estudio:
- Aunque nuestra población (n=42) es numéricamente similar a otros estudios [7, 12, 14, 35-37], una mayor proporción hubiera permitido resultados estadísticos más significativos.
- Dado que la clínica no revela el grado de afectación vestibular, la selección de casos retrospectivos puede incluir un sesgo y por ello consideramos que la mejor manera de estudiar este síndrome es realizando pruebas vestibulares de forma precoz a todo paciente con SSI.
- La procedencia de los datos de un solo hospital disminuye su representatividad respecto a la población general. Sin embargo, al permitir una evaluación más estricta y continua de los pacientes, se mejora la fiabilidad.
- Aunque el estudio audiológico fue precoz, tan sólo hemos realizado una exploración vestibular completa con menos de 6 meses a 9 pacientes, lo que probablemente ofrezca un menor porcentaje de lesión vestibular que, por otra parte, no consideramos que influya en la significación de los resultados obtenidos (Tabla 4, Anexo 4).
- Todas las exploraciones funcionales vestibulares tienen sus limitaciones, ofreciendo en ocasiones datos cuestionables, que fueron rechazados.
CONCLUSIONES
En el síndrome de SSI+SV, la severidad de la hipoacusia se correlaciona con el daño general del laberinto y a su vez, la disfunción vestibular es mayor en caso de hipoacusia profunda.
El pronóstico final, no sólo depende de la importancia del SV acompañante y del grado de hipoacusia, sino también de los receptores vestibulares implicados (tipo y número), de la edad del paciente, de los factores de riesgo vascular y de la etiopatogenia del proceso, entre otros.
De los receptores vestibulares estudiados (sáculo y CS), el sáculo y el CSP se dañan con más frecuencia y el pronóstico de la mejoría auditiva depende significativamente de la función del CSH.
BIBLIOGRAFÍA
1.Chandrasekhar SS, Tsai Do BS, Schwartz SR, Bontempo LJ, Faucett EA, Finestone SA, et al. Clinical Practice Guideline: Sudden Hearing Loss (Update). Otolaryngol Head Neck Surg. 2019;161(1_suppl):S1-S45. https://doi.org/10.1177/0194599819859885. PMID: 31369359.
2.Herrera M, García Berrocal JR, García Arumí A, Lavilla MJ, Plaza G; Grupo de Trabajo de la Comisión de Audiología de la SEORL. Actualización del consenso sobre el diagnóstico y tratamiento de la sordera súbita idiopática. 2019;70(5):290-300. https://doi.org/10.1016/j.otorri.2018.04.010. PMID: 30093087.
3.Schuknecht HF, Donovan ED. The pathology of idiopathic sudden sensorineural hearing loss. Arch Otorhinolaryngol. 1986;243(1):1-15. https://doi.org/10.1007/BF00457899. PMID: 3707419.
4.Merchant SN, Adams JC, Nadol JB Jr. Pathology and pathophysiology of idiopathic sudden sensorineural hearing loss. Otol Neurotol. 2005;26(2):151-160. https://doi.org/10.1097/00129492-200503000-00004. PMID: 15793397.
5.Quaranta N, Longo G, Dadduzio S, Squeo V, Scarano E, Picciotti PM. Ocular and cervical vestibular-evoked myogenic potentials in idiopathic sudden sensorineural hearing loss (ISSHL) without vertigo: VEMPs in ISSHL. Eur Arch Otorhinolaryngol. 2020;277(2):409-414. https://doi.org/10.1007/s00405-019-05724-x. PMID: 31773241.
6.Rauch SD. Clinical practice. Idiopathic sudden sensorineural hearing loss. N Engl J Med. 2008;359(8):833-840. https://doi.org/10.1056/NEJMcp0802129. PMID: 18716300.
7.Kim CH, Choi HR, Choi S, Lee YS, Shin JE. Patterns of nystagmus conversion in sudden sensorineural hearing loss with vertigo. Medicine (Baltimore). 2018;97(43):e12982. https://doi.org/10.1097/MD.0000000000012982. PMID: 30412127.
8.Hao W, Ye L, Yu H, Li H. Prognosis of vestibular dysfunction in idiopathic sudden sensorineural hearing loss with vertigo: a prospective cohort study. J Neurol. 2023;270(11):5516-5526. https://doi.org/10.1007/s00415-023-11894-w. PMID: 37517037.
9.Korres S, Stamatiou GA, Gkoritsa E, Riga M, Xenelis J. Prognosis of patients with idiopathic sudden hearing loss: role of vestibular assessment. J Laryngol Otol. 2011;125(3):251-257. https://doi.org/10.1017/S0022215110002082. PMID: 21054906.
10. Guan R, Zhao Z, Guo X, Sun J. The semicircular canal function tests contribute to identifying unilateral idiopathic sudden sensorineural hearing loss with vertigo. Am J Otolaryngol. 2020;41(3):102461. https://doi.org/10.1016/j.amjoto.2020.102461. PMID: 32201018.
11. Niu X, Zhang Y, Zhang Q, Xu X, Han P, Cheng Y, et al. The relationship between hearing loss and vestibular dysfunction in patients with sudden sensorineural hearing loss. Acta Otolaryngol. 2016;136(3):225-231. https://doi.org/10.3109/00016489.2015.1110750. PMID: 26587580.
12. Fujimoto C, Egami N, Kinoshita M, Sugasawa K, Yamasoba T, Iwasaki S. Involvement of vestibular organs in idiopathic sudden hearing loss with vertigo: an analysis using oVEMP and cVEMP testing. Clin Neurophysiol. 2015;126(5):1033-1038. https://doi.org/10.1016/j.clinph.2014.07.028. PMID: 25200460.
13. Benito-Orejas JI, Ramírez-Salas JE, Mena-Domínguez EA, Duque-Holguera V, Muñoz-Moreno MF, Santos-Pérez J. Sordera súbita idiopática: factores pronóstico y resultados del tratamiento de rescate con dexametasona intratimpánica. ORL [Internet]. 23 de noviembre de 2022 [citado 8 de enero de 2024];14(1):e29939. Disponible en: https://revistas.usal.es/cinco/index.php/2444-7986/article/view/29939
14. Pogson JM, Taylor RL, Young AS, McGarvie LA, Flanagan S, Halmagyi GM, et al. Vertigo with sudden hearing loss: audio-vestibular characteristics. J Neurol. 2016;263(10):2086-2096. https://doi.org/10.1007/s00415-016-8214-0. PMID: 27435969.
15. Khetarpal U. Investigations into the cause of vertigo in sudden sensorineural hearing loss. Otolaryngol Head Neck Surg. 1991 Sep;105(3):360-71. https://doi.org/10.1177/019459989110500303. PMID: 1945420.
16. Inagaki T, Cureoglu S, Morita N, Terao K, Sato T, Suzuki M, et al. Vestibular system changes in sudden deafness with and without vertigo: a human temporal bone study. Otol Neurotol. 2012;33(7):1151-1155. https://doi.org/10.1097/MAO.0b013e3182635440. PMID: 22872175.
17. Yoon TH, Paparella MM, Schachern PA, Alleva M. Histopathology of sudden hearing loss. Laryngoscope. 1990;100(7):707-715. https://doi.org/10.1288/00005537-199007000-00006. PMID: 2362530.
18. Wang Y, Wang L, Jing Y, Yu L, Ye F. Association Between Hearing Characteristics/Prognosis and Vestibular Function in Sudden Sensorineural Hearing Loss With Vertigo. Front Neurol. 2020;11:579757. https://doi.org/10.3389/fneur.2020.579757. PMID: 33391149.
19. Seo HW, Chung JH, Byun H, Lee SH. Vestibular mapping assessment in idiopathic sudden sensorineural hearing loss. Ear Hear. 2022;43(1):242-949. https://doi.org/10.1097/AUD.0000000000001129. PMID: 34524151.
20. Zhou Y, Wu Y, Wang J. Otolithic organ function in patients with profound sensorineural hearing loss. J Otol. 2016;11(2):73-77. https://doi.org/10.1016/j.joto.2016.05.002. PMID: 29937813.
21. Liu Y, Leng Y, Zhou R, Liu J, Wang H, Xia K, et al. Video Head Impulse Test Findings in Patients With Benign Paroxysmal Positional Vertigo Secondary to Idiopathic Sudden Sensorineural Hearing Loss. Front Neurol. 2022;13:877777. https://doi.org/10.3389/fneur.2022.877777. PMID: 35720082.
22. Lim KH, Jeong YJ, Han MS, Rah YC, Cha J, Choi J. Comparisons among vestibular examinations and symptoms of vertigo in sudden sensorineural hearing loss patients. Am J Otolaryngol. 2020;41(4):102503. https://doi.org/10.1016/j.amjoto.2020.102503. PMID: 32402694.
23. Lee JY, Kim CH, Park JS, Kim MB. Peripheral Vestibulopathy Presenting as Acute Vertigo and Spontaneous Nystagmus with Negative Video Head Impulse Test. Otolaryngol Head Neck Surg. 2019;160(5):894-901. https://doi.org/10.1177/0194599818825458. PMID: 30665325.
24. Wilson WR, Laird N, Kavesh DA. Electronystagmographic findings in idiopathic sudden hearing loss. Am J Otolaryngol. 1982;3(4):279-285. https://doi.org/10.1016/s0196-0709(82)80067-7. PMID: 6983308.
25. Shaia FT, Sheehy JL. Sudden sensori-neural hearing impairment: a report of 1,220 cases. Laryngoscope. 1976;86(3):389-398. https://doi.org/10.1288/00005537-197603000-00008. PMID: 1256213.
26. Maia NPD, Lopes KC, Ganança FF. Vestibular evoked myogenic potentials in the prognosis of sudden hearing loss ‒ a systematic review. Braz J Otorhinolaryngol. 2020;86(2):247-254. https://doi.org/10.1016/j.bjorl.2019.10.001. PMID: 31796375.
27. Kim MB, Ban JH. Benign paroxysmal positional vertigo accompanied by sudden sensorineural hearing loss: a comparative study with idiopathic benign paroxysmal positional vertigo. Laryngoscope. 2012;122(12):2832-2836. https://doi.org/10.1002/lary.23607. PMID: 22915291.
28. Song JJ, Yoo YT, An YH, Yoo JC, Kim JS, Koo JW. Comorbid benign paroxysmal positional vertigo in idiopathic sudden sensorineural hearing loss: an ominous sign for hearing recovery. Otol Neurotol. 2012;33(2):137-141. https://doi.org/10.1097/MAO.0b013e318241c27a. PMID: 22215458.
29. Rambold H, Boenki J, Stritzke G, Wisst F, Neppert B, Helmchen C. Differential vestibular dysfunction in sudden unilateral hearing loss. Neurology. 2005;64(1):148-151. https://doi.org/10.1212/01.WNL.0000148599.18397.D2. PMID: 15642923.
30. Yu H, Li H. Vestibular Dysfunctions in Sudden Sensorineural Hearing Loss: A Systematic Review and Meta-analysis. Front Neurol. 2018;9:45. https://doi.org/10.3389/fneur.2018.00045. PMID: 29459846.
31. Sánchez-Gómez H, Marco-Carmona M, Intraprendente-Martini JF. Exploración vestibuloespinal. ORL [Internet]. 5 de enero de 2018 [citado 8 de enero de 2024];9(2):139-143. Disponible en: https://revistas.usal.es/cinco/index.php/2444-7986/article/view/orl.17424.
32. Pérez-Vázquez P, Franco-Gutiérrez V. La prueba calórica. ORL [Internet]. 18 de enero de 2018 [citado 8 de enero de 2024];9(3):193-221. Disponible en: https://revistas.usal.es/cinco/index.php/2444-7986/article/view/orl.17699.
33. Jongkees LB, Maas JP, Philipszoon AJ. Clinical nystagmography. A detailed study of electro-nystagmography in 341 patients with vertigo. Pract Otorhinolaryngol (Basel). 1962;24:65-93. PMID: 14452374.
34. Rasmussen H. Sudden deafness. Acta Otolaryngol (1949) 37:65–70. doi:10.3109/00016484909120217.
35. Kizkapan DB, Karlidag T, Basar F, Kaygusuz I, Keles E, Akyigit A, et al. Vestibular functions in patients with idiopathic sudden sensorineural hearing loss and its relation to prognosis. Auris Nasus Larynx. 2022;49(3):374-382. https://doi.org/10.1016/j.anl.2021.09.009. PMID: 34674887.
36. Jiang Z, Zhang J, Wang Y, Huang X, Yao Q, Feng Y, et al. Contribution of Audiogram Classification in Evaluating Vestibular Dysfunction in Sudden Sensorineural Hearing Loss With Vertigo. Front Neurol. 2021;12:667804. https://doi.org/10.3389/fneur.2021.667804. PMID: 33995264.
37. Liu J, Zhou RH, Liu B, Leng YM, Liu JJ, Liu DD, et al. Assessment of balance and vestibular functions in patients with idiopathic sudden sensorineural hearing loss. J Huazhong Univ Sci Technolog Med Sci. 2017;37(2):264-270. https://doi.org/10.1007/s11596-017-1726-8. PMID: 28397037.
38. D’Albora R, Civizonas M, Araujo R, Fernández S. Irrigación e inervación del oído interno, su aplicación clínica. En: Carmona S y Kattah JC. Manejo del Síndrome Vestibular Agudo. 1ª ed. Buenos Aires: Akadia, 2017. p. 3-12.
39. Hong SM, Yeo SG. Clinical analysis of patients with idiopathic sudden sensorineural hearing loss and benign paroxysmal positional vertigo. Acta Otolaryngol. 2013;133(5):439-42. https://doi.org/10.3109/00016489.2012.754996. PMID: 23294198.
40. Vivas EX, Panella NJ, Baugnon KL. Spontaneous Labyrinthine Hemorrhage: A Case Series. Otolaryngol Head Neck Surg. 2018;159(5):908-913. https://doi.org/10.1177/0194599818785900. PMID: 29966483.
41. Kim CH, Shin JE, Park HJ, Koo JW, Lee JH. Concurrent posterior semicircular canal benign paroxysmal positional vertigo in patients with ipsilateral sudden sensorineural hearing loss: is it caused by otolith particles? Med Hypotheses. 2014;82(4):424-427. https://doi.org/10.1016/j.mehy.2014.01.015. PMID: 24529913.
42. Chen XH, Zeng CJ, Fang ZM, Zhang R, Cheng JM, Lin C. The Natural History of Labyrinthine Hemorrhage in Patients With Sudden Sensorineural Hearing Loss. Ear Nose Throat J. 2019;98(5):E13-E20. https://doi.org/10.1177/0145561319834862. PMID: 30909739.
43. Murofushi T, Tsubota M, Suzuki D. Idiopathic acute high-tone sensorineural hearing loss accompanied by vertigo: vestibulo-cochlear artery syndrome? Consideration based on VEMP and vHIT. J Neurol. 2019;266(8):2066-2067. https://doi.org/10.1007/s00415-019-09353-6. PMID: 31065783.
44. Kim C, Sohn JH, Jang MU, Hong SK, Lee JS, Kim HJ, et al. Ischemia as a potential etiologic factor in idiopathic unilateral sudden sensorineural hearing loss: Analysis of posterior circulation arteries. Hear Res. 2016;331:144-151. https://doi.org/10.1016/j.heares.2015.09.003. PMID: 26368028.
45. Byun H, Chung JH, Lee SH. Clinical implications of posterior semicircular canal function in idiopathic sudden sensorineural hearing loss. Sci Rep. 2020;10(1):8313. https://doi.org/10.1038/s41598-020-65294-5. PMID: 32433568.
46. Iwasaki S, Takai Y, Ozeki H, Ito K, Karino S, Murofushi T. Extent of lesions in idiopathic sudden hearing loss with vertigo: study using click and galvanic vestibular evoked myogenic potentials. Arch Otolaryngol Head Neck Surg. 2005;131(10):857-862. https://doi.org/10.1001/archotol.131.10.857. PMID: 16230586.
47. Perez N, Rama-Lopez J. Head-impulse and caloric tests in patients with dizziness. Otol Neurotol. 2003;24(6):913-7. https://doi.org/10.1097/00129492-200311000-00016. PMID: 14600474.
ANEXOS
Anexo 1
Tabla 1. Población de estudio (N= 42 pacientes). Factores epidemiológicos y características de la hipoacusia y síndrome vestibular.
VARIABLE |
N |
PORCENTAJE |
Número pacientes |
42 |
25% de las SSI |
Fechas de consulta |
2005 a 2022 |
|
Género:
|
42 15 27 |
100 % 36 % 64 % |
Edad media y DS:
Rango general |
42 54.5±20 años 54.5±19 años 54.5±19 años 4 a 80 años |
100 % |
Antecedentes:
|
42 20 4 0 |
100% 48 % 10 % 0 % |
RMN
|
39/42 26/39 13/39 |
93% 67% 33% |
HIPOACUSIA |
|
|
Lado:
|
42 25 16 1 |
100 % 59.5 % 38 % 2.5 % |
Grado:
|
42 3 8 10 21 |
100 % 7 % 19 % 24 % 50 % |
Configuración:
|
41 13 2 26 |
98 % 32 % 5 % 63 % |
Evolución:
|
41 26 11 4 |
98 % 63 % 27 % 10 % |
Hipoacusia contralateral |
10/42 |
24 % |
VÉRTIGO |
|
|
Presentación:
|
41 30 10 1 |
98 % 73 % 24 % 3 % |
Duración:
|
39 18 17 4 |
93 % 46 % 44 % 10 % |
Pruebas vestibulares realizadas (N=38 pacientes):
|
18/38 34/38 32/38 32/38 31/38 |
47% 89% 84% 84% 82% |
|
4/42 32/42 6/42 |
10%, (todos con RMN normal) 76% 14% (4 con VNG y 2 con vHIT de CSH) |
|
29/38 8/32 7/32 |
76% 25% 22% |
Anexo 2
Tabla 2. Relación entre presencia/ausencia de factor de riesgo vascular, edad > o < de 60 años, género y RM normal o patológica; con todos los factores analizados: edad, género, FR vascular, lado, hipoacusia profunda, caída tonos agudos, mejoría auditiva, hipoacusia contralateral, vértigo agudo, RM patológica y resultado patológico de las pruebas de función vestibular aplicadas: prueba térmica, vHIT patológico de CSH, CSP, CSA y cVEMP. La alteración vestibular total se obtiene del sumatorio de los datos obtenidos en las distintas pruebas vestibulares previas. Las casillas sombreadas señalan una relación estadísticamente significativa (p<0,05).
|
FR VASCULAR |
EDAD |
GÉNERO |
RMN |
||||
Con |
Sin |
> 60 años |
< 60 años |
Hombres |
Mujeres |
Patológica |
Normal |
|
N |
20/42 (48%) |
22/42 (52%) |
21/42 (50%) |
21/42 (50%) |
15/42 (36%) |
27/42 (64%) |
13/39 (33%) |
26/39 (67%) |
Edad media ± DS |
66±9 años |
46±21 años |
69,5±6 años |
39±15,7 años |
54.5±20años |
54.5±19años |
65±12 años |
49±19 años |
Edad > 60 años (21/42: 50%) < 60 años (21/42: 50%) |
16/20 (80%) 4/20 (20%) |
5/22 (23%) 17/22 (77%) |
|
|
8/15 (53%) 7/15 (47%) |
13/27 (48%) 14/27 (52%) |
10/13 (77%) 3/13 (23%) |
9/26 (35%) 17/26 (65%) |
Género Hombres (15/42: 36%) Mujeres (27/42: 64%) |
8/20 (40%) 12/20 (60%) |
7/22 (32%) 15/22 (68%) |
8/21 (38%) 13/21 (62%) |
7/21 (33%) 14/21 (67%) |
|
|
4/13 (31%) 9/13 (69%) |
9/26 (35%) 17/26 (65%) |
FR vascular (20/42: 48%) |
|
|
16/21 (76%) |
4/21 (19%) |
8/15 (53%) |
12/27 (44%) |
8/13 (62%) |
11/26 (42%) |
Lado Derecho (24/42: 57%) Izquierdo (17/42: 40%) |
12/20 (60%) 8/20 (40%) |
13/21 (62%) 8/21 (38%) |
14/21 (67%) 7/21 (33%) |
10/20 (50%) 10/20 (50%) |
11/14 (79%) 3/14 (21%) |
13/27 (48%) 14/27 (52%) |
9/12 (75%) 3/12 (25%) |
13/26 (50%) 13/26 (50%) |
Hipoacusia Profunda (21/42: 50%) |
13/20 (65%) |
8/22 (36%) |
12/21 (57%) |
9/21 (43%) |
12/15 (80%) |
9/27 (33%) |
10/13 (77%) |
10/26 (38%) |
Caída tonos agudos (13/41: 32%) |
5/20 (25%) |
8/21 (38%) |
4/21 (19%) |
9/20 (45%) |
2/15 (13%) |
11/26 (42%) |
5/13 (38%) |
7/25 (28%) |
Mejoría auditiva (11/41: 27%) |
5/20 (25%) |
6/21 (29%) |
4/21 (19%) |
7/20 (35%) |
2/15 (13%) |
9/26 (35%) |
1/13 (8%) |
9/25 (36%) |
Hipoacusia contralateral (10/42: 24%) |
8/20 (40%) |
2/22 (9%) |
8/21 (38%) |
2/21 (10%) |
5/15 (33%) |
5/27 (19%) |
5/13 (38%) |
4/26 (15%) |
Vértigo agudo (30/41: 73%) |
15/20 (75%) |
15/21 (71%) |
15/20 (75%) |
15/21 (71%) |
12/15 (80%) |
18/26 (69%) |
10/12 (83%) |
18/26 (69%) |
RMN patológica (13/39: 33%) |
8/19 (42%) |
5/20 (25%) |
10/19 (53%) |
3/20 (15%) |
4/13 (31%) |
9/26 (35%) |
|
|
Prueba Térmica patológica (13/18: 72%) |
6/8 (75%) |
7/10 (70%) |
8/10 (80%) |
5/8 (62.5%) |
5/7 (71%) |
8/11 (73%) |
9/9 (100%) |
4/9 (44%) |
vHIT CSH patológico (13/34: 38%) |
9/16 (56%) |
4/18 (22%) |
10/15 (67%) |
3/19 (16%) |
6/12 (50%) |
7/22 (32%) |
8/10 (80%) |
3/21 (14%) |
vHIT CSP patológico (16/32: 50%) |
8/14 (57%) |
8/18 (44%) |
9/13 (69%) |
7/19 (37%) |
7/11 (64%) |
9/21 (43%) |
6/9 (67%) |
8/20 (40%) |
vHIT CSA patológico (6/32: 19%) |
4/14 (29%) |
2/18 (11%) |
5/13 (38%) |
1/19 (5%) |
4/11 (36%) |
2/21 (10%) |
4/9 (44%) |
1/20 (5%) |
cVEMP patológico (16/31: 52%) |
9/13 (69%) |
7/18 (39%) |
9/13 (69%) |
7/18 (39%) |
7/11 (64%) |
9/20 (45%) |
7/9 (78%) |
8/20 (40%) |
Altc. Vestibular TOTAL (64/147: 44%) |
36/65 (55%) |
28/72 (39%) |
41/64 (64%) |
23/83 (28%) |
29/52 (56%) |
35/95 (37%) |
34/46 (74%) |
24/90 (27%) |
Anexo 3
Tabla 3. Relación entre las características de la pérdida auditiva: lado, grado de hipoacusia, conFiguración, evolución y presencia de hipoacusia contralateral; y todos los factores analizados: edad, género, FR vascular, lado, hipoacusia profunda, caída tonos agudos, mejoría auditiva, hipoacusia contralateral, vértigo agudo, RM patológica y resultado patológico de las pruebas de función vestibular aplicadas: prueba térmica, vHIT patológico de CSH, CSP, CSA y cVEMP. La alteración vestibular total se obtiene del sumatorio de los datos obtenidos en las distintas pruebas vestibulares previas. Las casillas sombreadas señalan una relación estadísticamente significativa (p<0,05).
|
LADO |
GRADO DE HIPOACUSIA |
CONFIGURACIÓN |
EVOLUCIÓN HIPOACUSIA |
HIPO CONTRALATERAL |
|||||
DERECHO |
IZQUIERDO |
Profunda |
Resto |
Caída agudos |
MEJORÍA |
ESTABLE |
Con |
Sin |
||
N |
24/42 (57%) |
17/42 (40%) |
21/42 (50%) |
21/42 (50%) |
13/41 (32%) |
11/41 (27%) |
26/41 (63%) |
10/42 (24%) |
32/42 (76%) |
|
Edad media ± DS 54.5±19 años |
58±19 años |
50±19 años |
59±15 años |
50±22 años |
47,5±23 años |
55±13 años |
54±20 años |
66±11 años |
51±20 años |
|
Edad > 60 años (21/42: 50%) < 60 años (21/42: 50%) |
14/24 (58%) 10/24 (42%) |
7/17 (41%) 10/17 (59%) |
12/21 (57%) 9/21 (43%) |
9/21 (43%) 12/21 (57%) |
4/13 (31%) 9/13 (69%) |
4/11 (36%) 7/11 (64%) |
14/26 (54%) 12/26 (46%) |
8/10 (80%) 2/10 (20%) |
13/32 (41%) 19/32 (59%) |
|
Género Hombres (15/42: 36%) Mujeres (27/42: 64%) |
11/24 (46%) 13/24 (54%) |
3/17 (18%) 14/17 (82%) |
12/21 (57%) 9/21 (43%) |
3/21 (14%) 18/21 (86%) |
2/13 (15%) 11/13 (85%) |
2/11 (18%) 9/11 (82%) |
13/26 (50%) 13/26 (50%) |
5/10 (50%) 5/10 (50%) |
10/32 (31%) 22/32 (69%) |
|
FR vascular (20/42: 48%) |
12/24 (50%) |
8/17 (47%) |
13/21 (62%) |
7/21 (33%) |
5/13 (38%) |
5/11 (45%) |
14/26 (54%) |
8/10 (80%) |
12/32 (37%) |
|
Lado Derecho (24/42: 57%) Izquierdo (17/42: 40%) |
|
|
13/20 (65%) 7/20 (35%) |
11/21 (52%) 10/21 (48%) |
9/13 (69%) 4/13 (31%) |
4/11 (36%) 7/11 (64%) |
18/25 (72%) 7/25 (28%) |
7/9 (78%) 2/9 (22%) |
17/32 (53%) 15/32 (47%) |
|
Hipoacusia Profunda (21/42: 50%) |
13/24 (54%) |
7/17 (41%) |
|
|
2/13 (15%) |
1/11 (9%) |
19/26 (73%) |
8/10 (80%) |
13/32 (41%) |
|
Caída tonos agudos (13/41: 32%) |
9/24 (37%) |
4/16 (25%) |
2/21 (10%) |
11/20 (55%) |
|
5/11 (45%) |
6/26 (23%) |
1/10 (10%) |
12/31 (39%) |
|
Mejoría auditiva (11/41: 27%) |
4/24 (17%) |
7/16 (44%) |
1/21 (5%) |
10/20 (50%) |
5/13 (38%) |
|
|
2/10 (20%) |
9/31 (29%) |
|
Hipoacusia contralateral (10/42: 24%) |
7/24 (29%) |
2/17 (12%) |
8/21 (38%) |
2/21 (10%) |
1/13 (8%) |
2/11 (18%) |
7/26 (27%) |
|
|
|
Vértigo agudo (30/41: 73%) |
18/24 (75%) |
12/16 (75%) |
17/20 (85%) |
13/21 (62%) |
8/13 (62%) |
7/11 (64%) |
23/26 (88%) |
6/10 (60%) |
24/31 (77%) |
|
RMN patológica (11/39: 28%) |
9/22 (41%) |
3/16 (19%) |
10/20 (50%) |
3/19 (16%) |
5/12 (42%) |
1/10 (10%) |
10/24 (42%) |
5/9 (56%) |
8/30 (27%) |
|
Prueba Térmica patológica (13/18: 72%) |
7/11 (64%) |
5/6 (83%) |
9/9 (100%) |
4/9 (44%) |
5/8 (62,5%) |
1/3 (33%) |
10/12 (83%) |
4/4 (100%) |
9/14 (64%) |
|
vHIT CSH patológico (13/34: 38%) |
9/19 (47%) |
3/14 (21%) |
11/17 (65%) |
2/17 (12%) |
2/11 (18%) |
1/10 (10%) |
10/19 (53%) |
6/9 (67%) |
7/25 (28%) |
|
vHIT CSP patológico (16/32: 50%) |
11/17 (65%) |
4/14 (29%) |
11/15 (73%) |
5/17 (29%) |
4/11 (36%) |
3/10 (30%) |
11/17 (65%) |
6/8 (75%) |
10/24 (42%) |
|
vHIT CSA patológico (6/32: 19%) |
4/17 (24%) |
1/14 (7%) |
6/15 (40%) |
0/17 (0%) |
0/11 (0%) |
1/10 (10%) |
4/17 (24%) |
4/8 (50%) |
2/24 (8%) |
|
cVEMP patológico (16/31: 52%) |
9/17 (53%) |
6/13 (46%) |
8/14 (57%) |
8/17 (47%) |
6/11 (55%) |
6/10 (60%) |
7/17 (41%) |
5/7 (71%) |
11/24 (46%) |
|
Altc. Vestibular TOTAL (64/147: 44%) |
40/81 (49%) |
19/61 (31%) |
45/70 (64%) |
19/77 (25%) |
17/52 (33%) |
12/43 (28%) |
42/82 (57%) |
25/37 (68%) |
39/111 (35%) |
|
Anexo 4
Tabla 4. Relación entre las características del vértigo: clínica vertiginosa aguda o no, duración del vértigo (horas, días), exploración > o < de 6 meses, resultado global normal o patológico de todas las pruebas vestibulares utilizadas; y todos los factores analizados: edad, género, FR vascular, lado, hipoacusia profunda, caída tonos agudos, mejoría auditiva, hipoacusia contralateral, vértigo agudo, RM patológica y resultado patológico de las pruebas de función vestibular aplicadas: prueba térmica, vHIT patológico de CSH, CSP, CSA y cVEMP. La alteración vestibular total se obtiene del sumatorio de los datos obtenidos en las distintas pruebas vestibulares previas. Las casillas sombreadas señalan una relación estadísticamente significativa (p<0,05).
|
CLÍNICA VERTIGINOSA |
DURACIÓN DEL VÉRTIGO |
ÚLTIMA EXPLORACIÓN |
RESULTADO GLOBAL DE TODAS LAS PRUEBAS VESTIBULARES |
||||
VÉRTIGO AGUDO |
RESTO |
DÍAS |
HORAS |
> 6 meses |
< 6 meses |
TODAS NORMAL |
TODAS PATOL |
|
N |
30/41 (73%) |
11/41(27%) |
18/39 (46%) |
17/39 (44%) |
33/42 (79%) |
9/42 (21%) |
8/32 (25%) |
6/32 (19%) |
Edad media ± DS |
56±18 años |
50±24 años |
54±19 años |
58±18 años |
54±19 años |
55±21años |
47±16 años |
63±13 años |
Edad > 60 años (21/42: 50%) < 60 años (21/42: 50%) |
15/30 (50%) 15/30 (50%) |
5/11 (45%) 6/11 (55%) |
9/18 (50%) 9/18 (50%) |
9/17 (53%) 8/17 (47%) |
16/33 (48%) 17/33 (52%) |
5/9 (56%) 4/9 (44%) |
3/8 (37,5%) 5/8 (62,5%) |
5/6 (83%) 1/6 (17%) |
Género Hombres (15/42: 36%) Mujeres (27/42: 64%) |
12/30 (40%) 18/30 (60%) |
3/11 (27%) 8/11 (73%) |
7/18 (39%) 11/18 (61%) |
6/17 (35%) 11/17 (65%) |
9/33 (27%) 24/33 (73%) |
6/9 (67%) 3/9 (33%) |
2/8 (25%) 6/8 (75%) |
4/6 (67%) 2/6 (33%) |
FR vascular (20/42: 48%) |
15/30 (50%) |
5/11 (45%) |
8/18 (44%) |
10/17 (59%) |
16/33 (48%) |
3/9 (33%) |
3/8 (37%) |
4/6 (67%) |
Hipoacusia Profunda (21/42: 50%) |
17/30 (57%) |
3/11 (27%) |
9/18 (50%) |
8/17 (47%) |
17/33 (52%) |
4/9 (44%) |
2/8 (25%) |
6/6 (100%) |
Caída tonos Agudos (13/41: 32%) |
8/30 (27%) |
5/10 (50%) |
7/18 (39%) |
6/17 (35%) |
10/32 (31%) |
3/9 (33%) |
3/8 (37%) |
0/6 (0%) |
Mejoría auditiva (11/41: 27%) |
7/30 (23%) |
4/10 (40%) |
4/18 (22%) |
6/17 (35%) |
9/32 (28%) |
2/9 (22%) |
4/8 (50%) |
1/6 (17%) |
Hipoacusia contralateral (10/42: 24%) |
6/30 (20%) |
4/11 (36%) |
5/18 (28%) |
5/17 (29%) |
8/33 (24%) |
2/9 (22%) |
1/8 (12,5%) |
4/6 (67%) |
Vértigo agudo (30/41: 73%) |
|
|
10/18 (56%) |
15/17 (88%) |
23/32 (72%) |
7/9 (78%) |
7/8 (87%) |
3/5 (60%) |
RMN patológica (11/39: 28%) |
10/28 (36%) |
2/10 (20%) |
5/18 (28%) |
7/15 (47%) |
11/33 (33%) |
2/6 (33%) |
1/7 (14%) |
4/5 (80%) |
Prueba Térmica patológica (13/18: 72%) |
10/13 (77%) |
2/4 (50%) |
7/10 (70%) |
4/5 (80%) |
12/15 (80%) |
1/3 (33%) |
|
|
vHIT CSH patológico (13/34: 38%) |
9/25 (36%) |
3/8 (37%) |
3/12 (25%) |
8/15 (53%) |
8/26 (31%) |
5/8 (62%) |
|
|
vHIT CSP patológico (16/32: 50%) |
11/23 (48%) |
4/8 (50%) |
6/12 (50%) |
7/13 (54%) |
9/24 (37%) |
7/8 (87%) |
|
|
vHIT CSA patológico (6/32: 19%) |
3/23 (13%) |
2/8 (25%) |
2/12 (17%) |
3/13 (23%) |
3/24 (12%) |
3/8 (37%) |
|
|
cVEMP patológico (16/31: 52%) |
9/22 (41%) |
6/8 (75%) |
6/11 (55%) |
8/13 (62%) |
10/23 (43%) |
6/8 (75%) |
|
|
Altc. Vestibular TOTAL (64/147: 44%) |
41/106 (39%) |
17/36 (47%) |
24/57 (42%) |
30/59 (51%) |
35/109 (32%) |
28/44 (64%) |
|
|
Anexo 5
Tabla 5. Relación entre el resultado patológico o normal de las pruebas vestibulares utilizadas: prueba térmica, vHIT de CSH, CSP, CSA y cVEMP; y todos los factores analizados: edad, género, FR vascular, lado, hipoacusia profunda, caída tonos agudos, mejoría auditiva, hipoacusia contralateral, vértigo agudo, RM patológica y el resultado patológico de las pruebas de función vestibular aplicadas. La alteración vestibular total se obtiene del sumatorio de los datos obtenidos en las distintas pruebas vestibulares previas. Las casillas sombreadas señalan una relación estadísticamente significativa (p<0,05).
|
PRUEBA TÉRMICA (18/38: 47%) |
vHIT CSH (34/38: 89%) |
vHIT CSP (32/38: 84%) |
vHIT CSA (32/38: 84%) |
cVEMP (31/38: 82%) |
|||||
PATOLÓGICA |
NORMAL |
PATOLÓGICO |
NORMAL |
PATOLÓGICO |
NORMAL |
PATOLÓGICO |
NORMAL |
DISMINUIDO |
NORMAL |
|
N |
13/18 (72%) |
5/18 (28%) |
13/34 (38%) |
21/34 (62%) |
16/32 (50%) |
16/32 (50%) |
6/32 (19%) |
26/32 (81%) |
16/31 (52%) |
15/31 (48%) |
Edad media ± DS |
59±21 años |
49±20 años |
62±11 años |
47±20 años |
59±13 años |
44±20 años |
63±13 años |
49±19 años |
55±19 años |
48±19 años |
Edad > 60 años (21/42: 50%) < 60 años (21/42: 50%) |
8/13 (62%) 5/13 (38%) |
2/5 (40%) 3/5 (60%) |
10/13 (77%) 3/13 (23%) |
5/21 (24%) 16/21 (76%) |
9/16 (56%) 7/16 (44%) |
4/16 (25%) 12/16 (75%) |
5/6 (83%) 1/6 (17%) |
8/26 (31%) 18/26 (69%) |
9/16 (56%) 7/16 (44%) |
4/15 (27%) 11/15 (73%) |
Género Hombres (15/42: 36%) Mujeres (27/42: 64%) |
5/13 (38%) 8/13 (62%) |
2/5 (40%) 3/5 (60%) |
6/13 (46%) 7/13 (54%) |
6/21 (29%) 15/21 (71%) |
7/16 (44%) 9/16 (56%) |
4/16 (25%) 12/16 (75%) |
4/6 (67%) 2/6 (33%) |
7/26 (27%) 19/26 (73%) |
7/16 (44%) 9/16 (56%) |
4/15 (27%) 11/15 (73%) |
FR vascular (20/42: 48%) |
6/13 (46%) |
2/5 (40%) |
9/13 (69%) |
7/21 (33%) |
8/16 (50%) |
6/16 (37%) |
4/6 (67%) |
10/26 (38%) |
9/16 (56%) |
4/15 (27%) |
Lado Derecho (24/42: 57%) Izquierdo (17/42: 40%) |
7/12 (58%) 5/12 (42%) |
4/5 (80%) 1/5 (20%) |
9/12 (75%) 3/12 (25%) |
10/21 (48%) 11/21 (52%) |
11/15 (73%) 4/15 (27%) |
6/16 (37%) 10/16 (63%) |
4/5 (80%) 1/5 (20%) |
13/26 (50%) 13/26 (50%) |
9/15 (60%) 6/15 (40%) |
8/15 (53%) 7/15 (47%) |
Hipoacusia Profunda (21/42: 50%) |
9/13 (69%) |
0/5 (0%) |
11/13 (85%) |
6/21 (29%) |
11/16 (69%) |
4/16 (25%) |
6/6 (100%) |
9/26 (35%) |
8/16 (50%) |
6/15 (40%) |
Caída tonos agudos (13/41: 32%) |
5/13 (38%) |
3/5 (60%) |
2/13 (15%) |
9/20 (45%) |
4/16 (25%) |
7/15 (47%) |
0/6 (0%) |
11/25 (44%) |
6/15 (40%) |
5/15 (33%) |
Mejoría auditiva (11/41: 27%) |
1/13 (8%) |
2/5 (40%) |
1/13 (8%) |
9/20 (45%) |
3/16 (19%) |
7/15 (47%) |
1/6 (17%) |
9/25 (36%) |
6/15 (40%) |
4/15 (27%) |
Hipoacusia contralateral (10/42: 24%) |
4/13 (31%) |
0/5 (0%) |
6/13 (46%) |
3/21 (14%) |
6/16 (37%) |
2/16 (12%) |
4/6 (67%) |
4/26 (15%) |
5/16 (31%) |
2/15 (13%) |
Vértigo agudo (30/41: 73%) |
10/12 (83%) |
3/5 (60%) |
9/12 (75%) |
16/21 (76%) |
11/15 (73%) |
12/16 (75%) |
3/5 (60%) |
20/26 (77%) |
9/15 (60%) |
13/15 (87%) |
RMN patológica (11/39: 28%) |
9/13 (69%) |
0/5 (0%) |
8/11 (73%) |
2/20 (10%) |
6/14 (43%) |
3/15 (20%) |
4/5 (80%) |
5/24 (21%) |
7/15 (47%) |
2/13 (15%) |
Prueba Térmica patológica (13/18: 72%) |
|
|
5/5 (100%) |
5/9 (56%) |
6/8 (75%) |
4/6 (67%) |
4/4 (100%) |
6/10 (60%) |
6/8 (75%) |
4/6 (67%) |
vHIT CSH patológico (13/34: 38%) |
5/10 (50%) |
0/4 (0%) |
|
|
9/16 (56%) |
2/16 (12%) |
6/6 (100%) |
5/26 (19%) |
9/16 (56%) |
2/15 (13%) |
vHIT CSP patológico (16/32: 50%) |
6/10 (60%) |
2/4 (50%) |
9/11 (82%) |
7/21 (33%) |
|
|
6/6 (100%) |
10/26 (38%) |
10/16 (63%) |
6/15 (40%) |
vHIT CSA patológico (6/32: 19%) |
4/10 (40%) |
0/4 (0%) |
6/11 (55%) |
0/21 (0%) |
6/16 (37%) |
0/16 (0%) |
|
|
6/16 (37%) |
0/15 (0%) |
cVEMP patológico (16/31: 52%) |
6/10 (60%) |
2/4 (50%) |
9/11 (82%) |
7/20 (35%) |
10/16 (62%) |
6/15 (40%) |
6/6 (100%) |
10/25 (40%) |
|
|
Altc. Vestibular TOTAL (58/115: 50%) |
21/40 (52%) |
4/16 (25%) |
29/38 (76%) |
19/71 (27%) |
31/56 (55%) |
12/53 (23%) |
22/22 (100%) |
31/87 (36%) |
31/56 (55%) |
12/51 (24%) |