eISSN 2444-7986
DOI: https://doi.org/10.14201/orl.23207
ARTÍCULO DE REVISIÓN
PREVALENCIA DE TUMORES METASTÁSICOS EN LA GLÁNDULA TIROIDES. REVISIÓN SISTEMÁTICA Y METANÁLISIS
Prevalence of Metastatic Tumors in the Thyroid Gland. Systematic Review and Meta-Analysis
Lucía RODRIGO-GÓMEZ; José Luis PARDAL-REFOYO; Ángel BATUECAS-CALETRÍO
1 Universidad de Salamanca. Facultad de Medicina. Departamento de Cirugía.
1,2 Servicio de Otorrinolaringología y Cirugía de Cabeza y Cuello. Hospital Universitario de Salamanca. Instituto de Investigación Biomédica de Salamanca (IBSAL).
Salamanca. España
Correspondencia luciarogg96@usal.es
Fecha de recepción: 24 de mayo de 2020
Fecha de aceptación: 28 de junio de 2020
Fecha de publicación: 7 de julio de 2020
Fecha de publicación del fascículo: 1 de marzo de 2021
Conflicto de intereses: Los autores declaran no tener conflictos de intereses
Imágenes: Los autores declaran haber obtenido las imágenes con el permiso de los pacientes
Política de derechos y autoarchivo: se permite el autoarchivo de la versión post-print (SHERPA/RoMEO)
Licencia CC BY-NC-ND. Licencia Creative Commons Atribución-NoComercial-SinDerivar 4.0 Internacional
Universidad de Salamanca. Su comercialización está sujeta al permiso del editor
RESUMEN: Introducción y objetivo: Los tumores metastásicos en la glándula tiroides complican el diagnóstico, el tratamiento y el pronóstico del paciente. El objetivo es conocer la prevalencia de las metástasis en la glándula tiroides referida en la literatura médica y los tumores primarios que con más frecuencia metastatizan en la glándula tiroides. Método: Se realizó una revisión bibliográfica sistemática en las bases de datos de PubMed, La Biblioteca Cochrane y Scopus. Los artículos seleccionados se dividieron en dos grupos, series clínicas de pacientes en los que se hallaron metástasis en tiroides (grupo A) y series de hallazgos de metástasis en tiroides en autopsias (grupo B). Se realizó metanálisis de prevalencia para cada grupo de artículos siguiendo el modelo de efectos aleatorios. Resultados: La prevalencia en cada grupo con su índice de confianza al 95 % fue 0.00479 (0.002-0.007) para el grupo A y 0.0362 (0.014-0.059) para el grupo B. La prevalencia de metástasis halladas en autopsias fue 7,58 veces mayor que en los estudios clínicos. En el grupo A la edad media fue 60.82 y en el grupo B 57.20. En ambos grupos las metástasis halladas en tiroides fueron más frecuentes en el sexo femenino. La localización del tumor primario fue diferente en ambos grupos, en el grupo A fue el cáncer de riñón y en el grupo B el cáncer de mama. La variabilidad de la prevalencia de metástasis en tiroides en los diferentes artículos de ambos grupos hace que este estudio tuviese una alta heterogeneidad (índice I2 y Q). Los funnel plot de ambos grupos indicaron alto sesgo de publicación. Discusión: La diferente prevalencia entre series clínicas y autopsias puede implicar que la detección de metástasis en tiroides en la clínica está infradiagnosticada. La razón de esto podría ser que las metástasis intratiroideas se presentan de forma asintomática siendo diagnosticadas como hallazgo casual en autopsias. En otras ocasiones se presentan como un nódulo tiroideo años después del tumor primario, lo que condiciona el diagnóstico.
Conclusiones: La prevalencia de metástasis en tiroides es superior en las series de autopsias que en series clínicas (hasta 6.67 veces más frecuente en nuestro estudio). Las metástasis intratiroideas probablemente están infradiagnosticadas por cursar sin clínica siendo diagnosticadas como hallazgo casual en autopsias. Los tumores primarios más frecuentes fueron el riñón (series clínicas) y la mama (series de autopsias).
PALABRAS CLAVE: metástasis en tiroides; metástasis intratiroideas; prevalencia; neoplasia secundaria de tiroides; revisión; metanálisis.
SUMMARY: Introduction and objective: Metastatic tumors in thyroid complicate the diagnosis, treatment, and prognosis of the patient. The objective is to determine the prevalence of metastasis in the thyroid gland reported in the medical literature and to examine the primary tumors that most frequently metastasize to the thyroid gland. Method: A systematic bibliographic review was undertaken in the PubMed, The Cochrane Library and Scopus databases. The selected articles were divided into two groups, clinical series of patients in whom thyroid metastasis were found (group A) and series of findings of metastasis in thyroid at autopsy (group B). Prevalence meta- analysis were performed for each group of articles following the random effects model. Results: The prevalence in each group with its 95 % confidence index was 0.00479 (0.002-0.007) for group A and 0.0362 (0.014-0.059) for group B. The prevalence of metastasis found at autopsies was 6.67 times higher than in clinical studies. In group A the mean age was 60.82 and in group B it was 57.20. In both groups, metastases found in the thyroid were more frequent in the female sex. The location of the primary tumor was different in both groups, in group A it was kidney cancer and in group B it was breast cancer. The variability of the prevalence of thyroid metastasis in the different articles of both groups makes this study highly heterogeneous (index I2 and Q). The funnel plots of both groups indicated high publication bias. Discussion: The different prevalence between clinical series and autopsies may imply that the detection of thy- roid metastases in the clinic is underdiagnosed. The reason for this could be that intrathyroid metastases appear asymptomatically, being diagnosed as an incidental finding at autopsy. On other occasions they present as a thyroid nodule years after the primary tumor, which determines the diagnosis. Conclusions: The prevalence of thyroid metastases is higher in autopsy series than in clinical series (up to 7.58 times more frequent in our study). Intrathyroid metastasis are probably underdiagnosed because they are not clinical, and they are diagnosed as a casual finding at autopsy. The most frequent primary tumors were the kidney (clinical series) and the breast (autopsy series).
KEYWORDS: metastasis in thyroid; intrathyroid metastasis; prevalence; secondary thyroid neoplasm; review; meta-analysis.
INTRODUCCIÓN
La glándula tiroides está muy vascularizada y a pesar de ello, las metástasis intratiroideas no son frecuentes con localización del tumor primario variable de unos estudios a otros (riñón, pulmón, gastrointestinal y mama) [1-3].
El diagnóstico de las metástasis en tiroides es similar al del cáncer primario basado en la ecografía y la punción aspiración con aguja fina (PAAF).
Respecto al tratamiento del cáncer metastásico en tiroides, hay controversia sobre si la cirugía es la técnica de elección ya que la mayoría de los pacientes tienen enfermedad metastásica avanzada [4].
Los tumores metastásicos en la glándula tiroides complican el diagnóstico, el tratamiento y el pronóstico del paciente. Es por tanto interesante conocer la prevalencia del cáncer metastásico en la glándula tiroides y los órganos que con mayor frecuencia son origen del tumor primario. Esto puede tener influencia en la estrategia de diagnóstico y tratamiento de los pacientes afectados.
El objetivo principal de este estudio es conocer la prevalencia de las metástasis en la glándula tiroides referida en la literatura médica.
MATERIAL Y MÉTODO
Revisión sistemática en las bases de datos PubMed (https://pubmed.ncbi.nlm.nih.gov/), la Biblioteca Cochrane (https://www.cochranelibrary.com/es/) y Scopus (https://www.scopus.com/home.uri) de los artículos de tumores metastásicos en la glándula tiroides sin limitar el periodo de tiempo.
Criterios de inclusión: artículos que contenían las variables “metástasis tiroidea” “neoplasias secundarias” o “neoplasias metastásicas”, idioma (español, francés, alemán e inglés), tipo de estudio (revisiones, revisiones sistemáticas y metanálisis), humanos y que tuvieran los números totales de la muestra de pacientes y de las metástasis halladas y la localización del tumor primario.
Se siguieron las directrices PRISMA [5].
La estrategia de búsqueda y selección de artículos se resumen en la Figura 1. Tras la búsqueda inicial en las diferentes bases de datos y eliminando los duplicados se seleccionaron 82 artículos de los que se incluyeron 76. Se revisaron a texto completo y se excluyeron 66 artículos por no tener acceso al original (n=15) [49-62, 108], no informar del número total de pacientes revisados o de la localización del tumor primario (n=5) [76,79-81,96] y las publicaciones que no aportaban información relevante para el estudio (n=46) [63-73,75,77,82-95,97-107,109-116]. Quedaron excluidos artículos a los que no se tuvo acceso, no informaban de la muestra total de pacientes o de la localización del tumor primario [6-16, 117-141].
Se seleccionaron para el estudio 34 artículos [17-48,74,78].
Se evaluó la calidad de cada artículo incluido con el sistema GRADE [142,143] que se representa en la Tabla 1.
Análisis de datos. Se realizó metanálisis de prevalencia para cada grupo de artículos (series de casos clínicos y series de hallazgos en autopsia) siguiendo el modelo de efectos aleatorios. Se utilizó el programa estadístico Jamovi 1.2 (The jamovi project (2020), https://www.jamovi.org).
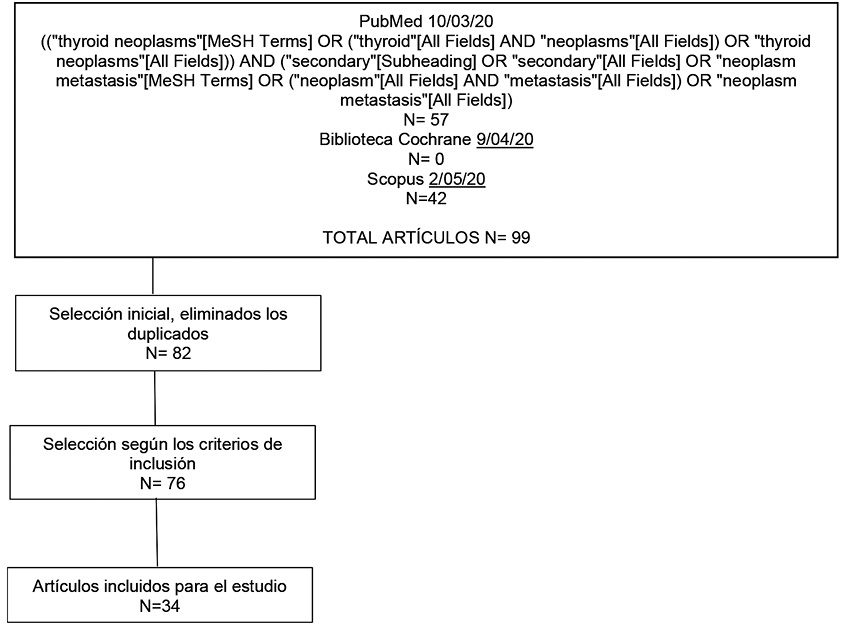
Figura 1. Esquema de selección de los artículos.
RESULTADOS
Los artículos seleccionados se dividieron en dos grupos, series clínicas de pacientes en los que se hallaron metástasis en tiroides (grupo A) y series de hallazgos de metástasis en tiroides en autopsias (grupo B) como figura en las tablas de resultados (Tablas 1 y 2).
En el grupo A la edad media fue 60.82± 4.26 años y en el grupo B 57.20±5.43 años. En ambos grupos las metástasis halladas en tiroides fueron más frecuentes en el sexo femenino con una relación de 1.19:1 en series clínicas (grupo A) y de 1.26:1 en autopsias (grupo B).
Tabla 1. Artículos que recogen metástasis en tiroides en series clínicas (grupo A).
|
Estudio |
Periodo |
n |
MT en tiroides |
Media edad |
Varón |
Mujer |
Nivel GRADE |
|
Aron et al. 2005 [17] |
1982-2002 |
20000 |
24 |
- |
7 |
17 |
++ |
|
Surov et al. 2016 [18] |
1997-2013 |
8849 |
33 |
69 |
18 |
15 |
++ |
|
Cesaretti et al. 2013 [19] |
1994-2010 |
918 |
3 |
61 |
1 |
2 |
+ |
|
Hegerova et al. 2015 [20] |
1980-2010 |
10798 |
97 |
63 |
53 |
44 |
++ |
|
Nakhjavani et al. 1997 [21] |
1985-1994 |
9118 |
43 |
66 |
23 |
20 |
++ |
|
Calzolari et al. 2008 [22] |
1995-2005 |
17122 |
25 |
61 |
11 |
14 |
++ |
|
Ishikawa et al 2011 [23] |
1988-2008 |
970 |
4 |
60 |
3 |
1 |
+ |
|
Pitale et al. 2000 [24] |
1988-1998 |
941 |
6 |
58 |
- |
- |
+ |
|
Pusztaszeri et al. 2015 [25] |
1992-2014 |
3480 |
62 |
59 |
34 |
28 |
++ |
|
HooKim et al. 2015 [26] |
1986-2013 |
15800 |
28 |
60.8 |
16 |
12 |
++ |
|
Lièvre et al. 2006 [27] |
1993-2004 |
5862 |
6 |
56 |
4 |
2 |
+ |
|
Moghaddam et al. 2013 [28] |
1993-2013 |
1295 |
6 |
- |
4 |
2 |
++ |
|
Leboulleux et al. 1999 [29] |
- |
130 |
6 |
54.2 |
1 |
5 |
+ |
|
Papi et al. 2007 [30] |
1993-2003 |
47813 |
36 |
66 |
19 |
17 |
++ |
|
Heffess et al. 2002 [31] |
1959-1998 |
37158 |
36 |
64.9 |
22 |
14 |
++ |
|
Cichon et al. 2006 [32] |
1984-2003 |
10057 |
17 |
62 |
13 |
4 |
++ |
|
Watts 1987 [33] |
1983-1984 |
70 |
4 |
57 |
2 |
2 |
+ |
|
Wood et al. 2004 [34] |
1985-2002 |
1016 |
15 |
63 |
10 |
5 |
++ |
|
Wychulis et al. 1964 [35] |
1907-1962 |
20262 |
14 |
55.7 |
8 |
6 |
+ |
|
Lin et al. 1998 [36] |
1977-1995 |
1013 |
14 |
55.3 |
8 |
6 |
++ |
|
Total |
212672 |
479 |
257 |
216 |
Tabla 2. Artículos que recogen metástasis en tiroides en autopsias (grupo B).
|
Estudio |
Período |
n |
MT en tiroides |
Media edad |
Varón |
Mujer |
Nivel GRADE |
|
Moghaddam et al. 2013 [28] |
1993-2013 |
2117 |
4 |
51,3 |
1 |
3 |
++ |
|
Shimaoka et al. 1962 [37] |
1955-1960 |
1980 |
188 |
- |
- |
- |
++ |
|
Rice 1934 [38] |
1933 |
89 |
9 |
- |
- |
- |
+ |
|
Abrams et al. 1950 [39] |
1943-1947 |
1000 |
19 |
- |
- |
- |
++ |
|
Mortensen et al. 1956 [40] |
1951-1953 |
467 |
18 |
- |
- |
- |
++ |
|
Watanabe et al. 1980 [41] |
1980 |
309 |
4 |
58,3 |
1 |
3 |
+ |
|
Willis 1931 [42] |
1923-1930 |
170 |
10 |
- |
3 |
7 |
+ |
|
Lam et al. 1988 [43] |
1951-1995 |
12955 |
79 |
62 |
38 |
41 |
++ |
|
Kitain 1922 [44] |
1930 |
452 |
14 |
- |
- |
- |
++ |
|
Total |
19539 |
345 |
43 |
54 |
La prevalencia en cada grupo con su índice de confianza al 95 % fue 0.00479 (0.002, 0.007) para el grupo A y 0.0362 (0.014, 0.059) para el grupo B, es decir 0.48 % (0.2 %, 0.7 %) en series clínicas y 3,62 % (1.4 %, 5.9 %) en autopsias.
Los Forest Plot de los metanálisis para calcular la prevalencia de metástasis en tiroides en los grupos A (Figura 2) y B (Figura 3) se estimaron en 19 artículos en el grupo A y en 9 estudios en el grupo B que disponían de todos los datos.
La prevalencia de metástasis halladas en autopsias fue 7.58 veces mayor que en los estudios clínicos. Esto puede implicar que la detección de metástasis en pacientes en la clínica está infradiagnosticada.
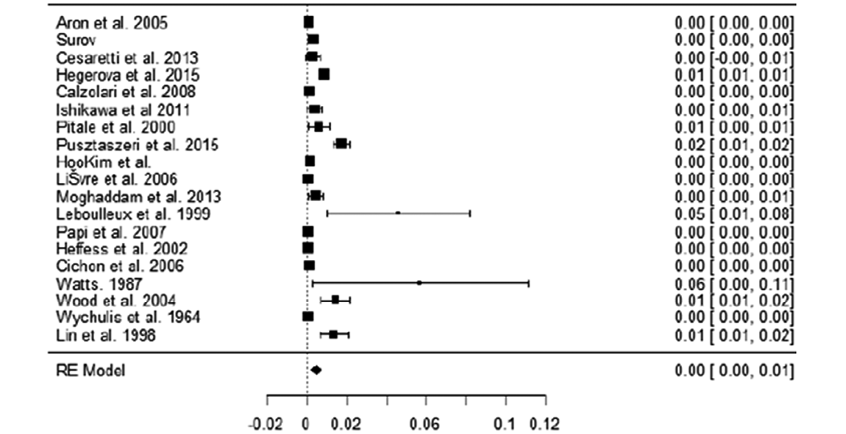
Figura 2. Forest plot de los metanálisis de prevalencia de los artículos de series clínicas (grupo A), 0.00479 (0.002, 0.007).
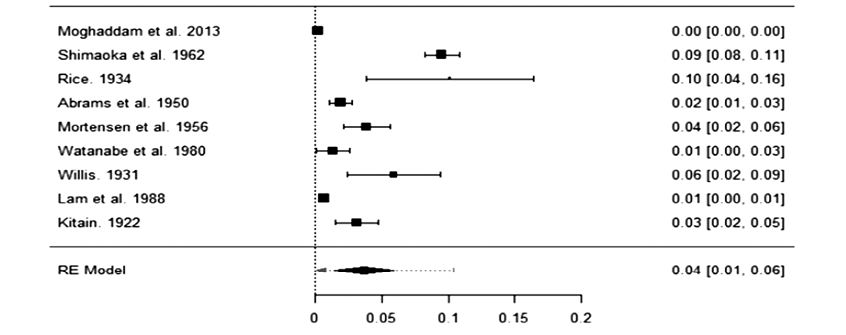
Figura 3. Forest plot de los metanálisis de prevalencia de los artículos de autopsias (grupo B), 0.0362 (0.014, 0.059).
La prevalencia de metástasis en tiroides es muy variable de unos estudios a otros con alta heterogeneidad (índice I2 y Q) en ambos grupos (ver Figuras 4 y 5).
Los funnel plot de ambos grupos indican alto sesgo de publicación (Figuras 6 y 7).
En la Tabla 3 se recogen las localizaciones de los tumores primarios en ambas series y en las Tablas 4 y 5 las localizaciones para cada uno de los grupos.
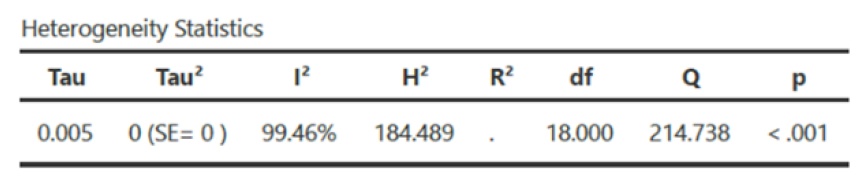
Figura 4. Heterogeneidad de artículos de metástasis en tiroides en series clínicas (grupo A).
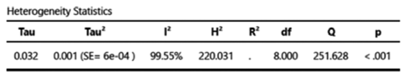
Figura 5. Heterogeneidad de artículos de metástasis en tiroides en hallazgos en autopsias (grupo B).
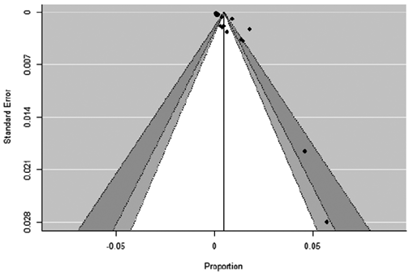
Figura 6. Funnel plot de artículos de metástasis en tiroides en series clínicas (grupo A).
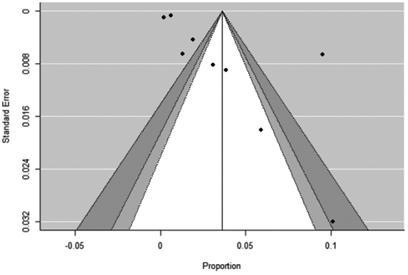
Figura 7. Funnel plot de artículos de metástasis en tiroides en hallazgos de autopsias (grupo B).
DISCUSIÓN
La prevalencia de metástasis en tiroides del estudio fue de 0.48 % en series clínicas (grupo A) y de 3.2 % en series de autopsias (grupo B). En la literatura, la prevalencia varía de unos estudios a otros. En series de autopsias, Moghaddam et al [28] refieren un 0.46 % y Rice [38] un 10.1 %. En las series clínicas la variabilidad es menor, Aron et al [17] calcula una prevalencia de 0.12 % y Wood et al [34] de 1.5 %.
La diferencia entre series clínicas y autopsias puede implicar que la detección de metástasis en tiroides en la clínica puede estar infradiagnosticada probablemente porque las metástasis intratiroideas se presentan de forma asintomática siendo diagnosticadas como hallazgo casual en autopsias o como un nódulo tiroideo años después del tumor primario.
En este estudio, la localización del tumor primario fue diferente en ambos grupos, en el grupo A fue el cáncer de riñón y en el grupo B el cáncer de mama. La mayor incidencia de metástasis de cáncer de mama en autopsias se puede explicar porque es un cáncer muy frecuente con un aumento de la supervivencia en las últimas décadas [42]. En series clínicas observamos que el primer lugar lo ocupa el riñón que, a pesar de no ser de los cánceres más frecuentes, se diagnostica en estadios avanzados con enfermedad diseminada [144] y en segundo lugar el cáncer de pulmón que es el más prevalente a nivel mundial.
Nixon et al [45] realizaron una revisión bibliográfica sobre metástasis en tiroides en la cual el tumor primario más frecuente en series clínicas fue también el riñón, sin embargo, en series de autopsias fue el pulmón. La diferente localización entre la revisión de Nixon y este estudio podría deberse los artículos excluidos por no tener acceso a ellos, no disponer del número total de pacientes o de la localización del primario [6-16,49-62,76,79-81,96,108,117-141].
La variabilidad de la prevalencia de metástasis en tiroides en los diferentes artículos de ambos grupos hace que este estudio tenga una alta heterogeneidad. En el grupo A el índice I2 fue de 99,46 % y en el grupo B 99,55 %, considerando alta heterogeneidad a un valor mayor del 75 %. El índice Q refleja si la heterogeneidad es debida al azar o no, un p-valor menor a 0,05 indicó hetereogeneidad más allá del azar. Los funnel plot de ambos grupos nos indican alto sesgo de publicación, es decir, los estudios que tienen más probabilidad de ser publicados son los que tienen resultados estadísticamente significativos.
Con los resultados obtenidos se deduce que en posteriores investigaciones bibliográficas sería necesario establecer otros criterios de selección de artículos para ver si puede reducirse la heterogeneidad, así como planificar estudios multicéntricos prospectivos con mejores registros.
CONCLUSIONES
La prevalencia de metástasis en tiroides es superior en las series de autopsias que en series clínicas (hasta 7.58 veces más frecuente en nuestro estudio).
Las metástasis intratiroideas probablemente están infradiagnosticadas por cursar sin clínica siendo diagnosticadas como hallazgo casual en autopsias.
Los tumores primarios más frecuentes fueron el riñón (series clínicas) y la mama (series de autopsias).
DECLARACIÓN DE INTERESES
Este artículo procede del trabajo fin de grado presentado por la primera autora para la obtención del título de Grado en Medicina en la Facultad de Medicina de la Universidad de Salamanca en el curso académico 2019/2020.
Tabla 3. Tumores metastásicos en tiroides. Localización de los tumores primarios.
|
Metástasis series clínicas |
Metástasis autopsias |
Total |
|||
|
N |
‰ |
N |
‰ |
||
|
Mama |
42 |
87.7 |
85 |
246,4 |
127 |
|
Pulmón |
68 |
142 |
74 |
214,5 |
142 |
|
Riñón |
170 |
354.9 |
12 |
34,8 |
182 |
|
Colorrectal |
30 |
62.6 |
18 |
52,2 |
48 |
|
Gastrointestinal (esófago, estómago, intestino delgado) |
26 |
54.3 |
11 |
31,9 |
37 |
|
Ginecológico |
13 |
27.1 |
13 |
37,7 |
26 |
|
Piel |
21 |
43.8 |
20 |
58 |
41 |
|
2 |
4.2 |
1 |
2,9 |
3 |
|
|
1 |
2.1 |
6 |
17,4 |
7 |
|
|
Cabeza y cuello |
50 |
104.4 |
33 |
95,7 |
83 |
|
Hematológicos |
10 |
20.9 |
49 |
142 |
59 |
|
2 |
4.2 |
1 |
2,9 |
3 |
|
|
Sarcomas |
9 |
18.8 |
6 |
17,4 |
15 |
|
Hueso [42] |
0 |
0 |
1 |
2,9 |
1 |
|
Vejiga |
3 |
6.3 |
1 |
2,9 |
4 |
|
0 |
0 |
3 |
8,7 |
3 |
|
|
Miscelánea |
9 |
18.8 |
7 |
20,3 |
16 |
|
Desconocido |
23 |
48 |
4 |
11,6 |
27 |
|
Total |
479 |
345 |
824 |
||
Tabla 4. Localizaciones más frecuentes del tumor primario en artículos de series clínicas (grupo A)
|
Localización primario |
Artículo |
N |
Total ( %) |
|
Riñón |
Surov et al. 2016 [18] Cesaretti et al. 2013 [19] Nakhjavani et al. 1997 [21] Calzolari et al. 2008 [22] HooKim et al. 2015 [26] Heffess et al. 2002 [31] Cichon et al. 2006 [32] Wood et al. 2004 [34] Wychulis et al. 1964 [35] Hegerova et al. 2015 [20] |
26 3 14 15 14 36 13 4 8 21 |
154 (64.17 %) |
|
Pulmón |
Leboulleux et al. 1999 [29] Papi et al. 2007 [30] Lin et al. 1998 [36] Hegerova et al. 2015 [20] Ishikawa et al. 2011 [23] |
3 9 6 21 1 |
40 (16.67 %) |
|
Cabeza y cuello |
Aron et al. 2005 [17] Pusztaszeri et al. 2015 [25] |
12 16 |
28 (11.67 %) |
|
Colorrectal |
Pitale et al. 2000 [24] Lièvre et al. 2006 [27] Moghaddam et al. 2013 [28] Ishikawa et al. 2011 [23] Watts 1987 [33] |
3 6 2 1 1 |
13 (5.42 %) |
|
Mama |
Ishikawa et al. 2011 [23] Watts 1987 [33] |
1 1 |
2 (0.83 %) |
|
Hematológico |
Watts 1987 [33] |
1 |
1 (0.42 %) |
|
Carcinoide |
Watts 1987 [33] |
1 |
1 (0.42 %) |
|
Gastrointestinal |
Ishikawa et al. 2011 [23] |
1 |
1 (0.42 %) |
|
Total |
240 |
Tabla 5. Localizaciones más frecuentes del tumor primario en artículos de autopsias (grupo B).
|
Localización primario |
Artículo |
N |
Total ( %) |
|
Mama |
Shimaoka et al. 1962 [37] Willis 1931 [42] Kitain 1922 [44] Abrams et al. 1950 [39] |
52 4 8 9 |
73 (59.35 %) |
|
Pulmón |
Moghaddam et al. 2013 [28] Lam et al. 1988 [43] |
3 34 |
37 (30.08 %) |
|
Hematológico |
Mortensen et al. 1956 [40] |
5 |
5 (4.07 %) |
|
Cabeza y cuello |
Watanabe et al. 1980 [41] |
2 |
2 (1.63 %) |
|
Gastrointestinal |
Watanabe et al. 1980 [41] |
2 |
2 (1.63 %) |
|
Desconocido |
Rice 1934 [38] |
4 |
4 (3.25 %) |
|
Total |
123 |
BIBLIOGRAFÍA
1. Hundahl SA, Fleming ID, Fremgen AM, Menck HR. A national cancer data base report on 53,856 cases of thyroid carcinoma treated in the US, 1985-1995. Cancer. 1998;83:2638–2648. Disponible en: https://acsjournals.onlinelibrary.wiley.com/doi/10.1002/%28SICI%291097-0142%2819981215%2983%3A12%3C2638%3A%3AAID-CNCR31%3E3.0.CO%3B2-1
2. Kent WDT, Hall SF, Isotalo PA, Houlden RL, George RL, Groome PA. Increased incidence of differentiated thyroid carcinoma and detection of subclinical disease. CMAJ. 2007;177:1357–1361. Disponible en: https://www.cmaj.ca/content/177/11/1357
3. Zhou L, Chen L, Xu D, Shao Q, Guo Z, Ge M. Breast cancer metastasis to thyroid: a retrospective analysis. Afr Health Sci. 2017;17:1035-1043. Disponible en: https://www.ajol.info/index.php/ahs/article/view/164362
4. Piñeiro AG, Grosso AH, Lorenzo FG, Martínez HP, Gil PG, Parga GC et al. Metástasis en tiroides. Cir Esp. 2000;68:135–138. Disponible en: https://www.elsevier.es/es-revista-cirugia-espanola-36-articulo-metastasis-tiroides-12486
5. Moher D, Liberati A, Tetzlaff J, Altman DG. The PRISMA Group (2009) Preferred Reporting Items for Systematic Reviews and Meta-Analyses: The PRISMA Statement. PLoS Med 6(7): e1000097. https://journals.plos.org/plosmedicine/article?id=10.1371/journal.pmed.1000097
6. Chung SY, Kim EK, Kim JH, Oh KK, Kim DJ, Lee YH et al. Sonographic findings of metastatic disease to the thyroid. Yonsei Med J. 2001;42:411-417.
7. Villumsen AL, Mevik K, Fjøsne HE, Brekke MB, Haugen OA. Late onset metastases to the thyroid gland from renal carcinoma. Tidsskr Nor Laegeforen. 2013;133:2262–2265. Disponible en: https://tidsskriftet.no/en/2013/11/late-onset-metastases-thyroid-gland-renal-carcinoma
8. Romero Arenas MA, Ryu H, Lee S, Morris LF, Grubbs EG, Lee JE et al. The role of thyroidectomy in metastatic disease to the thyroid gland. Ann Surg Oncol. 2014;21:434-439.
9. Saito Y, Sugitani I, Toda K, Yamada K, Fujimoto Y. Metastatic thyroid tumors: ultrasonographic features, prognostic factors and outcomes in 29 cases. Surg Today. 2014;44:55–61.
10. Kim HK, Kim SS, Oak CY, Kim SJ, Yoon JH, Kang HC. Diffuse metastasis to the thyroid: unique ultrasonographic finding and clinical correlation. J Korean Med Sci. 2014;29:818–824. Disponible en: https://jkms.org/search.php?where=aview&id=10.3346/jkms.2014.29.6.818&code=006%203JKMS&vmode=PUBREADER
11. Vardar E, Erkan N, Bayol U, Yılmaz C, Dogan M. Metastatic tumours to the thyroid gland: report of 3 cases and brief review of the literature. Radiol Oncol. 2011;45:53–58.
12. Wey SL, Chang KM. Tumor-to-tumor metastasis: lung carcinoma metastasizing to thyroid neoplasms. Case Rep Pathol. 2015;2015:153932. Disponble en: https://www.hindawi.com/journals/cripa/2015/153932/
13. Lee MW, Batoroev YK, Odashiro AN, Nguyen GK. Solitary metastatic cancer to the thyroid: a report of five cases with fine- needle aspiration cytology. Cytojournal. 2007;4:5. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1808473/
14. Poon D, Toh HC, Sim CS. Two case reports of metastases from colon carcinoma to the thyroid. Ann Acad Med Singapore. 2004;33:100–102. Disponible en: http://www.annals.edu.sg/pdf200401/V33N1p100.pdf
15. Cheung WY, Brierley J, Mackay HJ. Treatment of rectal cancer metastases to the thyroid gland: report of two cases. Clin Colorectal Cancer. 2008;7:280–282.
16. McCabe DP, Farrar WB, Petkov TM, Finkelmeier W, O’Dwyer P, James A. Clinical and pathologic correlations in diseaes metastatic to the thyroid gland. American Journal of Surgery. 1985;150:519-523.
17. Aron M, Kapila K, Verma K. Role of fine- needle aspiration cytology in the diagnosis of secondary tumors of the thyroid— twenty years’ experience. Diagn Cytopathol. 2005;34:240-245.
18. Surov A, Machens A, Holzhausen HJ, Spielmann RP, Dralle H. Radiological features of metastases to the thyroid. Acta Radiol. 2016;57:444-450.
19. Cesaretti M, Trotta M, Varaldo E, Ansaldo G, Leale I, Borgonovo G. Metastases to the thyroid gland from renal cancer. Tumori. 2013;99:107–110.
20. Hegerova L, Griebeler ML, Reynolds JP, Henry MR, Gharib H. Metastasis to the thyroid gland: report of a large series from the Mayo Clinic. Am J Clin Oncol. 2015;38:338–342.
21. Nakhjavani MK, Gharib H, Goellner JR, van Heerden JA. Metastasis to the thyroid gland. A report of 43 cases. Cancer. 1997;79:574–578.
22. Calzolari F, Sartori PV, Talarico C, Parmeggiani D, Beretta E, Pezzullo L et al. Surgical treatment of intrathyroid metastases: preliminary results of a multicentric study. Anticancer Res 2008;28:2885–2888.
23. Ishikawa M, Hirano S, Tsuji T, Ito J. Management of metastasis to the thyroid gland. Auris Nasus Larynx. 2011;38:426–430.
24. Pitale SU, Sizemore GW, Bakhos R, DeJong SA, Flanigan RC, Emanuele NV Renal cell carcinoma with metastasis to the thyroid gland. Urol Onco. 2000;5:173–175
25. Pusztaszeri M, Wang H, Cibas ES, Celeste NP, Bongiovanni M, Ali S et al. Fine-needle aspiration biopsy of secondary neoplasms of the thyroid gland: a multiinstitutional study of 62 cases. Cancer Cytopathol 2015;123:19–29. Disponible en: https://acsjournals.onlinelibrary.wiley.com/doi/full/10.1002/cncy.21494
26. HooKim K, Gaitor J, Lin O, Reid MD. Secondary tumors involving the thyroid gland: A multi-institutional analysis of 28 cases diagnosed on fine-needle aspiration. Diagn Cytopathol. 2015;43:904–911.
27. Lièvre A, Leboulleux S, Boige V Travagli JP, Dromain C, Elias D et al. Thyroid metastases from colorectal cancer: the Institut Gustave Roussy experience. Eur J Cancer. 2006;42:1756–1759.
28. Moghaddam PA, Cornejo KM, Khan A. Metastatic carcinoma to the thyroid gland: a single institution 20-year experience and review of the literature. Endocr Pathol. 2013;24:116–124.
29. Leboulleux S, Baudin E, Young J, Caillou B, Lazar V, Pellegriti G et al. Gastroenteropancreatic neuroendocrine tumor metastases to the thyroid gland: differential diagnosis with medullary thyroid carcinoma. Eur J Endocrinol 1999;140:187–191. Disponible en: https://eje.bioscientifica.com/view/journals/eje/140/3/187.xml
30. Papi G, Fadda G, Corsello SM, Corrado S, Rossi ED, Radighieri E et al. Metastases to the thyroid gland: prevalence, clinicopathological aspects and prognosis: a 10-year experience. Clin Endocrinol (Oxf). 2007;66:565–571.
31. Heffess CS, Wenig BM, Thompson LD. Metastatic renal cell carcinoma to the thyroid gland. Aclinopathologic study of 36 cases. Cancer. 2002;95:1869–1878. Disponible en: https://acsjournals.onlinelibrary.wiley.com/doi/full/10.1002/cncr.10901?sid=nlm%3Apubmed
32. Cichon S, Anielski R, Konturek A, Barczynski M, Cichon W. Metastases to the thyroid gland: seventeen cases operated on in a single clinical center. Langenbecks Arch Surg. 2006;391:581–587.
33. Watts, N.B. Carcinoma metastatic to the thyroid: prevalence and diagnosis by fine- needle aspiration cytology. Am J of Med Sci. 1987;293:13–17.
34. Wood K, Vini L, Harmer C. Metastases to the thyroid gland: the Royal Marsden experience Eur J Surg Oncol. 2004;30:583–588.
35. Wychulis AR, Beahrs OH, Woolner LB. Metastasis of carcinoma to the thyroid gland. Ann Surg. 1964;160:169–177. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1408803/pdf/annsurg00936-0004.pdf
36. Lin JD, Weng HF, Ho YS. Clinical and pathological characteristics of secondary thyroid cancer. Thyroid. 1998;8:149–153.
37. Shimaoka K, Sokal JE, Pickren JW. Metastatic neoplasms in the thyroid gland. Pathological and clinical findings. Cancer. 1962;15:557–565. https://acsjournals.onlinelibrary.wiley.com/doi/abs/10.1002/1097-0142%28196205/06%2915%3A3%3C557%3A%3AAID-CNCR2820150315%3E3.0.CO%3B2-H
38. Rice CO. Microscopic metastases in the thyroid gland. Am J Pathol. 1934;10:407–412.1. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2062816/pdf/amjpathol00709-0114.pdf
39. Abrams HL, Spiro R, Goldstein N. Metastases in carcinoma; analysis of 1000 autopsied cases. Cancer. 1950;3:74–85. Disponible en: https://acsjournals.onlinelibrary.wiley.com/doi/abs/10.1002/1097-0142%281950%293%3A1%3C74%3A%3AAID-CNCR2820030111%3E3.0.CO%3B2-7
40. Mortensen J, Woolner LB, Bennett WA. Secondary malignant tumors of the thyroid gland. Cancer. 1956;9:306–309. Disponible en: https://acsjournals.onlinelibrary.wiley.com/doi/abs/10.1002/1097-0142%28195603/04%299%3A2%3C306%3A%3AAID-CNCR2820090217%3E3.0.CO%3B2-I
41. Watanabe I, Tsuchiya A. Secondary carcinoma of the thyroid gland. Jpn J Surg. 1980;10:130–136.
42. Willis RA. Metastatic tumours in the thyreoid gland. Am J Pathol. 1931;7:187-208.3. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2062637/pdf/amjpathol00728-0001.pdf
43. Lam KY, Lo CY. Metastatic tumors of the thyroid gland: a study of 79 cases in chinese patients. Arch Pathol Lab Med. 1998;122:37-41.
44. Kitain H. Zur kenntnis der haüfigkeit und der lokalisation von krebsmetastasen mit besonderer berücksichtigung ihres histologischen baus. Virchows Arch Path Anat. 1922;238:289–309.
45. Nixon IJ, Coca-Pelaz A, Kaleva AI, Triantafyllou A, Angelos P, Owen RP et al. Metastasis to the thyroid gland: a critical review. Ann Surg Oncol 2017;24:1533- 1539. Disponible en: https://link.springer.com/article/10.1245%2Fs10434-016-5683-4.
46. Straccia P, Mosseri C, Brunelli C, Rossi ED, Lombardi CP, Pontecorvi A et al. Diagnosis and treatment of metastases to the thyroid gland: a meta-analysis. Endocr Pathol 2017;28:112-120.
47. Kim TY, Kim WB, Gong G, Hong SJ, Shong YK. Metastasis to the thyroid diagnosed by fine-needle aspiration biopsy. Clin Endocrinology (Oxf). 2005;62:236–241.
48. Plonczak AM, DiMarco AN, Dina R, Gujral DM y Palazzo FF. Breast cancer metastases to the thyroid gland - an uncommon sentinel for diffuse metastatic disease: a case report and review of the literature. J Med Case Rep. 2017;11:269. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5609028/
49. Cruickshank JC. Leiomyosarcoma metastatic to the thyroid gland. Ear Nose Throat J. 1988;67:899-900.
50. Pusel J, Satge D, Auge B. Primary and secondary carcinomas of the thyroid gland with systematic discovery. Apropos of hundred thyroid glands removed at autopsies and review of the literature. Arch Anat Cytol Pathol. 1992;40:176-182.
51. Qari FA. Pattern of thyroid malignancy at a University Hospital in Western Saudi Arabia. Saudi Med J. 2004;25:866-870.
52. Khan A, Yasin S, Makhdoomi R, Bhat S. Fine needle aspiration cytology of “thyroid neoplasms” a ten year (1993-2003) study based on 400 neoplasms. JK Practitioner. 2004;11:135-143.
53. Castiglioni T, Paparatto A, Elsner B. Cáncer de tiroides: Variación en sus tipos histológicos entre 1958 y 2000, un análisis de 749 casos. Revista Argentina de Endocrinologia y Metabolismo. 2005;42:67-72.
54. Sanguinetti A, Polistena A, Lucchini R, Monacelli M, Triola, R Avenia S et al. Breast cancer metastases to thyroid gland: Our experience and review of literature. Minerva Chir. 2014;69:15-17.
55. Ferrara G, Ianniello G, Nappi O. Thyroid metastases from a ductal carcinoma of the breast. A case report. Tumori. 1997;83:783-787.
56. Kumamoto K, Utsumi Y, Sugano K, Hoshino M, Suzuki S, Takenoshita S. Colon carcinoma metastasis to the thyroid gland: report of a case with a review of the literature. Tumori. 2006;92:252-256.
57. Kung B, Aftab S, Madera M, Rosen D. Malignant melanoma metastatic to the thyroid gland: A case report and review of the literature. Ear Nose Throat J. 2009;88.
58. Lastra RR, Newman JG, Brooks JS, Huang JH. Ossifying fibromyxoid tumor metastatic to the thyroid: a case report and review of the literature. Ear Nose Throat J. 2014;93:221-223.
59. Rossini M, Ruffini L, Ampollini L, Cozzani F, Del Rio P. Synchronous thyroid metastasis from lung adenocarcinoma. Ann Ital Chir. 2015;86:560-562.
60. Astl J, Bahannan AA, Dušková J, Novák Z, Vlcek P, Betka J. Solitary metastasis of clear renal cell carcinoma to thyroid gland: Three reported cases with review of the literature. Gulf J Oncolog. 2017;1:67-71.
61. Singh M, Gupta P, Bhardwaj M. Fine needle aspiration cytology of thyroid metastasis: An unusual presentation of cervical carcinoma; a case report and review of literature. Indian J Pathol Microbiol. 2017;60:298-299.
62. Stasiak M, Michalak R, Lewinski A. Thyroid primary and metastatic malignant tumours of poor prognosis may mimic subacute thyroiditis - Time to change the diagnostic criteria: Case reports and a review of the literature. BMC Endocr Disord. 2019;19:86.
63. Ferrozzi F, Bova D, Campodonico F, De Chiara F, Conti G, Bassi P. US and CT findings of secondary neoplasms of the thyroid - A pictorial essay. Clinical Imaging. 1998;22:157-161
64. Pasieka J. Anaplastic cancer, lymphoma, and metastases of the thyroid gland. Surg Oncol Clin N Am. 1998;7:707-720.
65. Baloch Z, LiVolsi V. Neuroendocrine tumors of the thyroid gland. Am J Clin Pathol. 2001;115:56-67. Disponible en: https://www.researchgate.net/publication/11376263_Neuroendocrine_Tumors_of_the_Thyroid_Gland
66. Iesalnieks I, Woenckhaus M, Glockzin G, Schlitt HJ, Agha A. Schilddrüsenmetastasen eines nierenzellkarzinoms - Drei fallvorstellungen und übersicht der literature. Zent.bl Chir. 2006;131:235-239.
67. Untch B, Olson JA. Anaplastic thyroid carcinoma, thyroid lymphoma, and metastasis to thyroid. Surg Oncol Clin N A. 2006;15:661-679.
68. Cumbo-Nacheli G, De Sanctis JT, Chung MH. Proximal esophageal adenocarcinoma presenting as a thyroid mass: Case report and review of the literature. Thyroid. 2007;17:267-269.
69. Benvenga S. Update on thyroid cancer. Horm Metab Res. 2008;40:323-328.
70. Duggal NM, Horattas MC. Metastatic renal cell carcinoma to the thyroid gland. Endocr Pract. 2008;14:1040-1046.
71. Phillips JS, Lishman S, Jani P. Colonic carcinoma metastasis to the thyroid: A case of skip metastasis. J Laryngol Otol. 2005;119:834-836.
72. Bohn OL, de las Casas LE, Leon ME. Tumor-to-tumor metastasis: Renal cell carcinoma metastatic to papillary carcinoma of thyroid-report of a case and review of the literature. Head Neck Pathol. 2009;3:327-330. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2811566/
73. Sindoni A, Rizzo M, Tuccari G, Ieni A, Barresi V, Calbo L et al. Thyroid metastases from renal cell carcinoma: Review of the literature. Sci World J. 2010;10:590-602. Disponible en: https://www.researchgate.net/publication/42976093_Thyroid_Metastases_from_Renal_Cell_Carcinoma_Review_of_the_Literature
74. Syed MI, Stewart M, Syed S, Dahill S, Adams C, McLellan DR et al. Squamous cell carcinoma of the thyroid gland: Primary or secondary disease? J Laryngol Otol. 2011;125:3-9.
75. Chung AY, Tran TB, Brumund KT, Weisman RA, Bouvet M. Metastases to the thyroid: A review of the literature from the last decade. Thyroid. 2012;22:258-268.
76. Dustin SM, Jo VY, Hanley KZ, Stelow EB. High sensitivity and positive predictive value of fine-needle aspiration for uncommon thyroid malignancies. Diagn Cytopathol. 2012;40:416-421.
77. Albsoul N, Obeidat F, Hadidy A, Alzoubi M, Taib A, Shahait A. Isolated multiple bilateral thyroid metastases from prostatic adenocarcinoma: Case report and literature review. Endocr Pathol. 2013;24:36-39.
78. Montero PH, Ibrahimpasic T, Nixon IJ, Shaha AR. Thyroid metastasectomy. J Surg Oncol. 2014;109:36-41.
79. Cordes M, Kuwert T. Metastases of non- thyroidal tumors to the thyroid gland: A regional survey in middle franconia. Exp Clin Endocrinol Diabetes. 2014;122:273-276.
80. Beutner U, Leowardi C, Bork U, Lüthi C, Tarantino I, Pahernik S et al. Survival after renal cell carcinoma metastasis to the thyroid: Single center experience and systematic review of the literature. Thyroid. 2015;25:314-324.
81. Russell JO, Yan K, Burkey B, Scharpf J. Nonthyroid Metastasis to the thyroid gland: Case series and review with observations by primary pathology. Otolaryngol Head Neck Surg. 2016;155:961-968.
82. Costa MM, Belo S, Capela-Costa J, Costa J, Carvalho D. Malignant melanoma with synchronous thyroid metastases: Case report and literature review. Arch Endocrinol Metab. 2017;61:193-197. Disponible en: https://www.scielo.br/scielo.php?script=sci_arttext&pid=S2359-39972017000200193
83. Cai C, Shen H, Liu W, Ma J, Zhang Y, Yin L et al. Rare metastasis of nasopharyngeal carcinoma to the thyroid gland with subsequent metastatic abdominal lymph nodes. Medicine (Baltimore). 2017;96:8373. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5690711/
84. Gelsomino F, Lamberti G, Ambrosini V, Sperandi F, Agosti R, Morganti AG et al. Metachronous solitary metastasis to the thyroid gland from squamous cell carcinoma of the lung: A case report and literature review. Tumori. 2017;103:12-15.
85. Pastorello RG, Saieg MA. Metastases to the thyroid: Potential cytologic mimics of primary thyroid neoplasms. Arch Pathol Lab Med. 2019;143:394-399. Disponible en: https://www.archivesofpathology.org/doi/full/10.5858/arpa.2017-0570-RS
86. Liu R, Chen C, Huang X, Zhu Q, Xia Y. Ultrasonography of extrathyroidal diseases mimicking intrinsic thyroid lesions. Ultrasound Q. 2019;35:301-307.
87. Vatsyayan A, Mandlik D, Patel P, Sharma N, Joshipura A, Patel M et al. Metastasis of squamous cell carcinoma of the head and neck to the thyroid: a single institution’s experience with a review of relevant publications. Br J Oral Maxillofac Surg. 2019;57:609-615.
88. Haugen B, Nawaz S, Cohn A, Shroyer K, Bunn P, Liechty D et al. Secondary malignancy of the thyroid gland: A case report and review of the literature. Thyroid. 1994;4:297-300.
89. Palazzo F, Bradpiece H, Morgan M. Renal cell carcinoma metastasizing to the thyroid gland. Scand J Urol Nephrol. 1999;33:202- 204.
90. Kim C, Park Y, Ayala A, Ro J. Colonic adenocarcinoma metastatic to the thyroid gland: A case report with immunohistochemical investigation. J Korean Med Sci. 1999;14:455-459.
91. Kameyama K, Kamio N, Okita H, Hata J. Metastatic carcinoma in follicular adenoma of the thyroid gland. Pathol Res Pract. 2000;196:333-336.
92. Bult P, Verwiel JM, Wobbes T, Kooy-Smits MM, Biert J, Holland R. Malignant adenomyoepithelioma of the breast with metastasis in the thyroid gland 12 years after excision of the primary tumor. Case report and review of the literature. Virchows Archiv. 2000;436:158-166.
93. Miyakawa M, Sato K, Hasegawa M, Nagai A, Sawada T, Tsushima T et al. Severe thyrotoxicosis induced by thyroid metastasis of lung adenocarcinoma: A case report and review of the literature. Thyroid. 2001;11:883-888.
94. Schwender FT, Wollner I, Kunju LP, Nakhleh RE, Chan KM. Squamous cell carcinoma of the buccal mucosa with metastases to the pericardial cavity, lung and thyroid. Oral Oncol. 2002;38:114-116.
95. Giuffrida D, Ferraù F, Pappalardo A, Aiello RA, Bordonaro R, Cordio S et al. Metastasis to the thyroid gland: A case report and review of the literature. J Endocrinol Invest. 2003;26:560-563.
96. Benoit L, Favoulet P, Arnould L, Margarot A, Franceschini C, Collin F et al. Metastatic renal cell carcinoma of the thyroid gland: About seven cases and review of the literature. Ann Chir. 2004;129:218-223.
97. Fadare O, Parkash V, Fiedler P, Mayerson A, Asiyanbola B. Tumor-to-tumor metastasis to a thyroid follicular adenoma as the initial presentation of a colonic adenocarcinoma. Pathol Int. 2005;55:574-579.
98. Hanna WC, Ponsky TA, Trachiotis GD, Knoll SM. Colon cancer metastatic to the lung and the thyroid gland. Arch Surg. 2006;141:93-96.
99. Tysome JR, Sandison A, Clarke PM. Myxoid liposarcoma metastatic to the thyroid gland: A case report and literature review. J Laryngol Otol. 2006;120:511-513.
100. Bujons A, Pascual X, Rosales A, Villavicencio H. Metástasis tiroidea de un carcinoma renal, a propósito de un caso. Arch Esp Urol. 2006;59:811-813.
101. D’Antonio A, Addesso M, De Dominicis G, Boscaino A, Liguori G, Nappi O. Mucinous carcinoma of thyroid gland. Report of a primary and a metastatic mucinous tumour from ovarian adenocarcinoma with immunohistochemical study and review of literature. Virchows Arch. 2007;451:847-851.
102. Eloy JA, Mortensen M, Gupta S, Lewis MS, Brett EM, Genden EM. Metastasis of uterine leiomyosarcoma to the thyroid gland: Case report and review of the literature. Thyroid. 2007;17:1295-1297
103. Jankowska P, Teoh EM, Fisher C, Rhys- Evans PH, Nutting CM, Harrington KJ. Case report. Isolated intrathyroid metastasis from undifferentiated and squamous carcinoma of the head and neck: the case for surgery and re-irradiation. Brit J Radiol. 2008;81:154-156.
104. Baloch Z, LiVolsi V. Unusual Tumors of the Thyroid Gland. Endocrin Metab Clin. 2008;37:297-310.
105. Lee H, Chen F, Lo C, Wang C, Lo W, Luh S. Metastasis of gastric carcinoma to the thyroid and lung: A case report and review of literature. J Zhejiang Univ Sci B. 2010;11:542-546.
106. Woo Young K, Young Ran K, Sang Uk W, Jae Bok L. Pulmonary leiomyosarcoma metastatic to the thyroid gland: case report and review of the literature. Ann Endocrinol (Paris). 2011;72:314-316.
107. Chen ED, Cheng P, Yan XQ, Ye YL, Chen CZ, Ji XH et al. Metastasis of distal esophageal carcinoma to the thyroid with presentation simulating primary thyroid carcinoma: A case report and review of the literature. World J Surg Oncol. 2014;12:106. Disponible en: https://wjso.biomedcentral.com/articles/10.1186/1477-7819-12-106
108. Fuentes-Martínez N, Santos Juanes J, Vivanco-Allende B, Gagatek S. Nódulo tiroideo como primer signo de progresión de carcinoma de cérvix uterino. Acta Otorrinolaring Esp. 2015;66:353-355.
109. Ryan N, Walkden G, Lazic D, Tierney P. Collision tumors of the thyroid: A case report and review of the literature. Head Neck. 2015;37:125-129.
110. Schmid KW. Lymphknoten- und organmetastasen des schilddrüsenkarzinoms: Metastasen in der schilddrüse. Pathologe. 2015;36:171-175.
111. Khalil J, Elomrani F, Benoulaid M, Elkacemi H, Kebdani T, Errihani H et al. Isolated thyroid metastasis revealed an unknown lung adenocarcinoma: A case report. J Med Case Rep. 2015;9:221. Disponible en: https://jmedicalcasereports.biomedcentral.com/articles/10.1186/s13256-015-0663-z
112. Bokhari A, Tiscornia-Wasserman P. Cytology diagnosis of metastatic clear cell renal cell carcinoma, synchronous to pancreas, and metachronous to thyroid and contralateral adrenal: Report of a case and literature review. Diagn Cytopathol. 2017;45:161-167.
113. Can AS, Köksal G. Thyroid metastasis from small cell lung carcinoma: A case report and review of the literature. J Med Case Rep. 2015;9:231. Disponible en: https://jmedicalcasereports.biomedcentral.com/articles/10.1186/s13256-015-0707-4
114. Bayraktar Z, Albayrak S. Metastasis of renal cell carcinoma to the thyroid gland 9 years after nephrectomy: A case report and literature review. Arch Ital Urol Androl. 2017;89:151-153.
115. Pensabene M, Stanzione B, Cerillo I, Ciancia G, Cozzolino I, Ruocco R. It is no longer the time to disregard thyroid metastases from breast cancer: A case report and review of the literature. BMC Cancer. 2018;18:146. Disponible en: https://bmccancer.biomedcentral.com/articles/10.1186/s12885-018-4054-x
116. Wu ZH, Dai JY, Shi JN, Fang MY, Cao J. Thyroid metastasis from chondrosarcoma. Medicine (Baltimore). 2019;98. Disponible en: https://journals.lww.com/md-journal/Fulltext/2019/11220/Thyroid_metas%20tasis_from_chondrosarcoma.57.aspx
117. Muller M. Beitrag zur kenntnis der metastasenbildung maligner tumoren, nach statistischen zusammenstellungen aus den scktionsprotokollen des bernischen pathologischen Instituts. Bern, Switzerland: L. Scheim & Co.; 1892.
118. Symmers D. Metastasis of tumors; study of 298 cases of malignant growth exhibited among 5155 autopsies at Bellevue Hospital. Am J Med Sci. 1917;154:225.
119. Thorpe JD. Metastatic cancer in the thyroid gland; report of four cases. West J Surg Obstet Gynecol. 1954;62:574–576.
120. Hull OH. Critical analysis of two hundred twenty-one thyroid glands; study of thyroid glands obtained at necropsy in Colorado. AMA Arch Pathol. 1955;59:291–311.
121. Brierre JT, Dickson LG. Clinically unsuspected thyroid disease. GP. 1964;30:94–98.
122. Berge T, Lundberg S. Cancer in Malmo, 1958–1969. An autopsy study. Acta Pathol Microbiol Scand Suppl. 1977;1–235.
123. Silverberg SG, Vidone RA. Carcinoma of the thyroid in surgical and postmortem material. Analysis of 300 cases at autopsy and literature review. Ann Surg. 1966;164:291–299. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1477254/pdf/annsurg00446-0113.pdf
124. Mayo CW, Schlicke CP. Exogenous tumors of the thyroid gland. Am J Pathol. 1941;17:283–288.
125. Elliott RH Jr, Frantz VK. Metastatic carcinoma masquerading as primary thyroid cancer: a report of authors’ 14 cases. Ann Surg. 1960;151:551–561. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1613575/pdf/annsurg01301-0115.pdf
126. Harcourt-Webster JN. Secondary neoplasm of the thyroid presenting as a goitre. J Clin Pathol. 1965;18:282–287. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC472925/pdf/jclinpath00356-0022.pdf
127. Pillay SP, Angorn IB, Baker LW. Tumour metastasis to the thyroid gland. S Afr Med J. 1977;51:509–512.
128. Brady LW, O’Neill EA, Farber SH. Unusual sites of metastases. Semin Oncol. 1977;4:59–64.
129. Ericsson M, Biorklund A, Cederquist E, Ingemansson S, Akerman M. Surgical treatment of metastatic disease in the thyroid gland. J Surg Oncol. 1981;17:15–23.
130. Czech JM, Lichtor TR, Carney JA, van Heerden JA. Neoplasms metastatic to the thyroid gland. Surg Gynecol Obstet. 1982;155:503–505.
131. Ivy HK. Cancer metastatic to the thyroid: a diagnostic problem. Mayo Clin Proc. 1984;59:856–859.
132. Chacho MS, Greenebaum E, Moussouris HF, Schreiber K, Koss LG. Value of aspiration cytology of the thyroid in metastatic disease. Acta Cytol. 1987;31:705–712.
133. Smith SA, Gharib H, Goellner JR. Fine- needle aspiration. Usefulness for diagnosis and management of metastatic carcinoma to the thyroid. Arch Intern Med. 1987;147:311–312.
134. Michelow PM, Leiman G. Metastases to the thyroid gland: diagnosis by aspiration cytology. Diagn Cytopathol. 1995;13:209–213.
135. Rosen IB, Walfish PG, Bain J, Bedard YC. Secondary malignancy of the thyroid gland and its management. Ann Surg Oncol. 1995;2:252–256.
136. Chen H, Nicol TL, Udelsman R. Clinically significant, isolated metastatic disease to the thyroid gland. World J Surg. 1999;23:177–180.
137. De Ridder M, Sermeus AB, Urbain D, Storme GA. Metastases to the thyroid gland—a report of six cases. Eur J Intern Med. 2003;14:377–379.
138. Dequanter D, Lothaire P, Larsimont D, de Saint-Aubain de Somerhausen N, Andry G. Intrathyroid metastasis: 11 cases. Ann Endocrinol (Paris). 2004;65:205–208.
139. Mirallie E, Rigaud J, Mathonnet M, Gibelin H, Regenet N, Hamy A et al. Management and prognosis of metastases to the thyroid gland. J Am Coll Surg. 2005;200:203–207.
140. Gerges AS, Shehata SR, Gouda IA. Metastasis to the thyroid gland; unusual site of metastasis. J Egypt Natl Canc Inst. 2006;18:67–72.
141. Choi SH, Baek JH, Ha EJ, Choi YJ, Song DE, Kim JK et al. Diagnosis of metastasis to the thyroid gland: comparison of core- needle biopsy and fine-needle aspiration. Otolaryngol Head Neck Surg. 2016;154:618–625.
142. Aguayo JL, Flores B, Soria V. Sistema GRADE: clasificación de la calidad de la evidencia y graduación de la fuerza de la recomendación. Cir Esp. 2014;92:82-88. Disponible en: https://www.elsevier.es/es-revista-cirugia-espanola-36-articulo-sistema-grade-clasificacion-calidad-evidencia-S0009739X13003394
143. Schünemann H, Brożek J, Guyatt G, Oxman A. (2013). Manual GRADE para calificar la calidad de la evidencia y la fuerza de la recomendación (1ª Ed. en español). P.A Orrego & M.X. Rojas (Trans.) 2017. Publicación Original: http://gdt.guidelinedevelopment.org/app/handbook/handbook.html
144. Jasso RV, Brambila SE, Alcaraz ME. Factores pronósticos en cáncer renal localizado y localmente avanzado. Actas Urol Esp. 2008;32:320-324. Disponible en: http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S0210-48062008000300009